
Основы кулонометрического титрования по Карлу Фишеру
Введение
Кулонометрическое титрование по методу Карла Фишера представляет собой высокоточный и эффективный метод для количественного определения содержания воды в различных веществах. Основу метода составляет специфическая химическая реакция между водой и йодом, генерируемым электрохимическим путем. Этот метод является стандартом в области аналитической химии, так как позволяет определять даже малые количества воды, достигая уровня точности до микрограммов. Применяется он в широком диапазоне отраслей, таких как фармацевтика, пищевая промышленность, химия, нефтехимия и электроника.
Основная реакция Фишера, лежащая в основе данного метода, представляет собой взаимодействие спиртового раствора йода с водой в присутствии диоксида серы и основания, образующего соли, что можно выразить следующим уравнением:
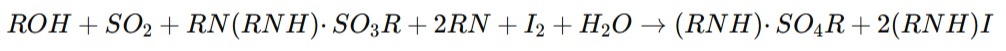
В классической методике Карла Фишера йод добавляется в систему как реагент. Однако при кулонометрическом титровании йод производится непосредственно в процессе анодного окисления ионов йодида на электроде, что позволяет избежать необходимости внесения йода в раствор и обеспечивает высокую точность определения.
Основные принципы и структура ячейки титрования
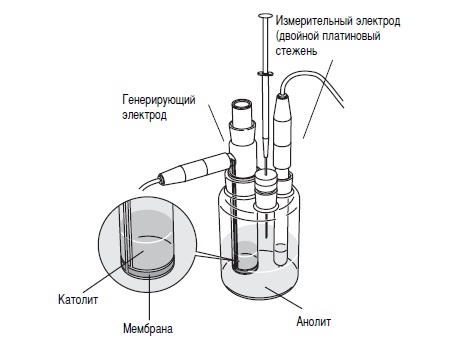
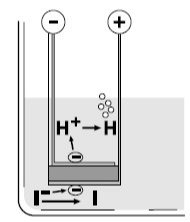
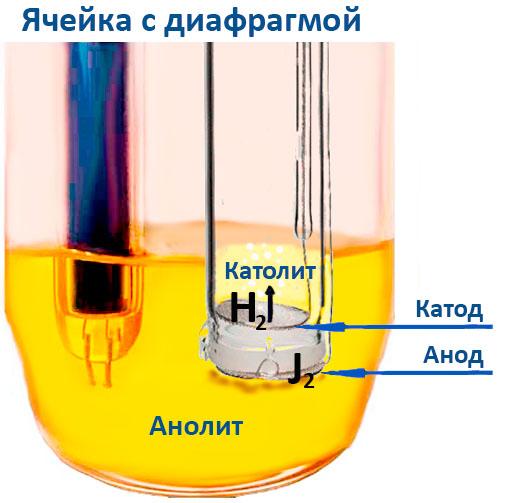
При кулонометрическом титровании йод образуется электрохимически на аноде, установленном в титрационной ячейке. Ячейка состоит из двух отделений — анодной и катодной камер, разделенных мембраной. В анодной камере, содержащей анолит, происходят основные реакции титрования. Анолит обычно состоит из диоксида серы, имидазола и йодида, а растворителями служат метанол или этанол. В зависимости от требований анализа, могут применяться и другие растворители, например, хлороформ, октанол, гексанол или этиленгликоль. Катодная камера содержит католит, который может представлять собой либо специальный реагент, либо тот же состав, что и в анодной камере.
В ячейке используются два типа электродов: генерирующий электрод и измерительный электрод. Генерирующий электрод окисляет йодид до йода, а измерительный электрод фиксирует окончание титрования. На аноде отрицательно заряженные ионы йодида теряют электроны, образуя йод, который затем вступает в реакцию с водой. В катодной камере ионы водорода восстанавливаются до водорода, и для этого в католит добавляются соли аммония, которые способствуют процессу.
Электрохимические реакции анода и катода
В анодной камере анодное окисление приводит к образованию йода из ионов йодида, который затем вступает в реакцию с водой, присутствующей в образце. Для эффективного прохождения этой реакции анолит должен содержать диоксид серы, имидазол и йодид. Основная реакция на аноде описывается следующим образом:
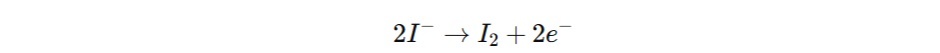
На катоде ионы водорода из католита восстанавливаются до молекулярного водорода. Чтобы упростить процесс восстановления, в католит часто добавляются соли аммония, и реакция на катоде выглядит так:
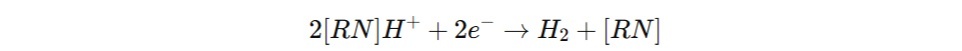
Теоретические основы кулонометрического метода
Кулонометрическое титрование основано на измерении электрического заряда, необходимого для выделения йода, и на законах электрохимии. Заряд, измеряемый в кулонах (Кл), является количеством электричества, проходящего по цепи за одну секунду при силе тока в один ампер:
1Кл=1А⋅1с
Для образования одного моля вещества, участвующего в электрохимической реакции с переносом одного электрона, требуется заряд в 96485 Кл. В методе Фишера два иона йодида, каждый из которых имеет один избыток электрона, объединяются для образования молекулы йода, которая далее реагирует с водой. Таким образом, на каждый моль воды требуется 2 × 96485 Кл, или примерно 10,72 Кл для определения 1 мг воды. Это означает, что количество выделившегося йода, а также содержание воды, можно рассчитать по величине тока и времени.
Виды генерирующих электродов
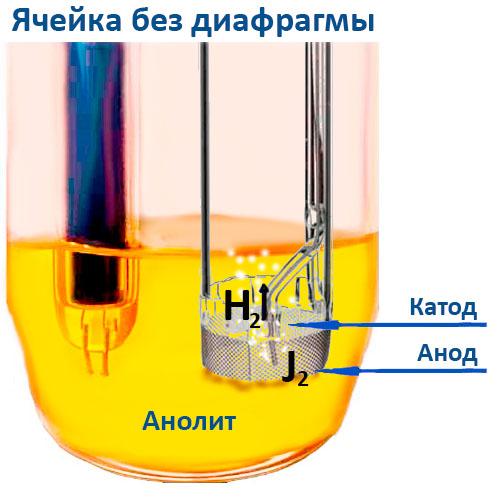
Генерирующий электрод без мембраны используется в кулонометрическом титровании по методу Карла Фишера и отличается рядом преимуществ по сравнению с мембранными ячейками. Основные преимущества ячеек без мембраны включают:
- Отсутствие риска загрязнения или засорения мембраны: благодаря отсутствию мембраны исключаются проблемы, связанные с ее чисткой и засорением, что особенно важно при анализе сложных или вязких образцов.
- Облегчение очистки ячеек: так как в конструкции отсутствует мембрана, очистка ячеек становится менее трудоемкой и требует меньше времени.
- Меньший дрейф: ячейки без мембраны обладают меньшими значениями дрейфа, что повышает стабильность и точность измерений, особенно при длительных анализах.
В традиционных ячейках мембрана служит барьером, предотвращающим попадание выделившегося йода к катоду, где он может восстановиться обратно до йодида. В безмембранных конструкциях этот эффект достигается благодаря образованию на поверхности катода газовой водородной пленки, которая препятствует прохождению молекул йода. Специальная форма катода дополнительно усиливает этот эффект, но небольшое количество йода может все же достичь катода. Для минимизации погрешности, возникающей в этом случае, в ячейках без мембраны рекомендуется использовать больший объем образца, что снижает влияние возможного восстановления йода на катоде.
Ограничения ячеек без мембраны
Несмотря на удобство и преимущества, безмембранные ячейки имеют некоторые ограничения. Они не подходят для анализа веществ, которые легко восстанавливаются. Например, водород, выделяющийся на катоде в процессе реакции, может восстанавливать такие соединения, как нитросоединения (например, нитробензол), а также другие легко восстанавливающиеся вещества, такие как ненасыщенные жирные кислоты. В этих случаях водород, образующийся на катоде, вступает в побочные реакции с данными веществами, приводя к образованию воды, что снижает точность измерений.
Ячейки без мембран широко применяются для определения содержания воды в различных веществах и смесях, которые не склонны к восстановлению в условиях кулонометрического титрования. К таким веществам относятся:
- углеводороды,
- спирты,
- простые и сложные эфиры,
- кетоны (с использованием специального реагента),
- эфирные масла и эссенции,
- минеральные масла,
- хлорированные углеводороды,
- фенолы (в большинстве случаев),
- ацетамид,
- пищевые масла.
Использование ячеек с мембраной
Тем не менее, существуют ситуации, когда ячейки с мембраной предпочтительнее. Они необходимы, когда:
- измеряются образцы с очень низким содержанием воды (менее 50 мкг на образец),
- требуется высокая точность результатов,
- анализируются нитросоединения,
- исследуются ненасыщенные углеводороды или другие вещества, которые легко восстанавливаются на катоде.
Таким образом, выбор между ячейками с мембраной и без нее определяется особенностями образца и требуемой точностью анализа.
Завершение реакции при кулонометрическом титровании по методу Фишера
В кулонометрическом титровании по методу Карла Фишера момент завершения реакции определяется с использованием бивольтаметрического принципа, также известного как "двухэлектродная потенциометрия". Этот метод основан на изменении напряжения на двухстержневом платиновом электроде, через который проходит ток небольшой величины, называемый током поляризации.
В начале и на протяжении титрования образующийся йод полностью реагирует с водой, присутствующей в образце, и не остается в анолите в свободной форме.
Когда вся вода в образце прореагировала с йодом, йод перестает участвовать в реакции и начинает накапливаться в растворе анолита. Наличие свободного йода увеличивает ионную проводимость раствора, вследствие чего для поддержания установленного тока поляризации требуется значительно меньшее напряжение. Это снижение напряжения на электроде служит признаком завершения реакции: процесс титрования прекращается при обнаружении свободного йода в анолите.
Момент окончания титрования определяется по достижению уровня напряжения, ниже которого система фиксирует окончание процесса. Этот уровень напряжения зависит, в основном, от величины тока поляризации, но может также изменяться в зависимости от типа электрода и состава анолита.
Таким образом, контроль напряжения на двухстержневом платиновом электроде позволяет точно определить момент, когда вся вода в образце прореагировала, и тем самым завершить процесс кулонометрического титрования.

Российский кулонометрический титратор Фишера ПЭ-9210. Узнать подробнее
Дрейф и влияние влажности в помещении
В кулонометрическом титровании неизбежно присутствует явление дрейфа, так как ячейка титратора не может быть абсолютно влагонепроницаемой. Мельчайшие частицы влаги из окружающей среды способны проникать внутрь ячейки, что приводит к постоянному поступлению воды в анолит. Количество воды, попадающей в ячейку за единицу времени, называется дрейфом и измеряется в микрограммах воды в минуту (мкг/мин). Величина дрейфа, хотя и невелика, существенно влияет на точность измерений, особенно при анализе образцов с низким содержанием воды.
Современные кулонометры оснащены ячейками с хорошей герметизацией, что снижает уровень проникновения влаги из окружающей среды. В режиме ожидания кулонометры непрерывно титруют воду, которая диффундирует в ячейку, а величина дрейфа отображается в реальном времени. Это позволяет оператору контролировать стабильность условий до начала анализа.
Перед началом титрования приборами фиксируется последнее значение дрейфа, которое затем учитывается при расчете итогового содержания воды в образце.
Уровень влажности в помещении, где проводится титрование, оказывает значительное влияние на величину дрейфа. Чем выше влажность окружающей среды, тем больше влаги может проникнуть в ячейку. В идеале, лаборатория должна поддерживать стабильную относительную влажность, предпочтительно не превышающую 50%, чтобы минимизировать дрейф и обеспечить более точные результаты.
При повышенной влажности дрейф может значительно увеличиваться, что потребует дополнительных усилий для стабилизации системы перед началом анализа. Влажность может также вызывать нестабильность показателей дрейфа, делая результаты менее предсказуемыми и требующими более частой коррекции. Поэтому, перед началом работы рекомендуется стабилизировать значение дрейфа, что достигается либо регулированием микроклимата, либо дополнительной выдержкой ячейки в режиме ожидания.
У нас вы найдете широкий ассортимент автоматических титраторов по Карлу Фишеру, идеально подходящих для анализа содержания влаги в твердых и жидких образцах. Мы предлагаем различные модели приборов, которые удовлетворят потребности как малых лабораторий, так и крупных производств. Наша команда профессионалов готова помочь вам настроить любые методы титрования, обеспечивая точность и надежность результатов. Если вы хотите узнать больше о моделях титраторов по Фишеру и их возможностях, свяжитесь с нами, и мы с радостью предоставим всю необходимую информацию! Узнать подробнее про модели титраторов.

Образцы
В кулонометрическом титровании для точного определения содержания воды в образце крайне важно, чтобы он не подвергался воздействию атмосферной влаги на этапе отбора и подготовки. Любая абсорбция или потеря влаги может существенно исказить результаты анализа.
Основной источник ошибок при определении содержания воды — проникновение атмосферной влаги, и точность анализа во многом определяется качеством отбора образца. Чтобы минимизировать влияние окружающей среды на образец, важно соблюдать несколько правил:
1. Сохранение однородности. Содержание воды в отбираемом образце должно быть аналогичным содержанию воды в исследуемом веществе.
2. Скорость отбора. Отбор образцов нужно производить как можно быстрее, чтобы минимизировать поглощение или испарение влаги из-за контакта с воздухом.
3. Равномерное распределение воды. В неполярных жидкостях, таких как масла, вода может скапливаться на дне или у поверхности. Перед отбором такие жидкости рекомендуется тщательно перемешивать.
4. Гигроскопичные материалы. Твердые гигроскопичные образцы могут иметь более высокое содержание воды на поверхности, если они контактировали с атмосферой. В таких случаях, при необходимости, можно использовать сушку образца в контролируемых условиях.
5. Материалы с низким содержанием воды. Такие образцы характеризуются высокой гигроскопичностью и требуют быстрого отбора с использованием сухого оборудования, например, стерильного шприца. Если требуется временное хранение, образцы следует поместить в плотно закрытые стеклянные флаконы с минимальным пространством над образцом.
Размер образца зависит от предполагаемого содержания воды и необходимой точности анализа. Оптимальный объем воды в образце составляет 0,5–2 мг. Если анализируются следовые количества воды, допустимы образцы с содержанием воды 0,1 мг или даже ниже при отсутствии жестких требований к точности.
Рекомендации по выбору веса образца:
При низком содержании воды в образце для повышения точности рекомендуется увеличивать массу образца, что снижает погрешности, связанные с абсорбцией атмосферной влаги. Однако размер пробы не должен превышать 10 г.
Для точного измерения, особенно при низком содержании воды, важно предотвратить попадание атмосферной влаги в процессе введения образца. Введение образца в ячейку следует производить аккуратно, при необходимости — с использованием шприца и других средств, ограничивающих контакт с воздухом. В случае твердых или вязких веществ можно использовать вспомогательные растворители, которые не содержат воды и совместимы с методом Фишера.

TT-15-KCV – Титратор Карла Фишера умеет делать и волюметрическое и кулонометрическое титрование
Особенности анализа некоторых образцов
При кулонометрическом титровании по методу Фишера некоторые образцы требуют особых условий для успешного анализа. Это связано с особенностями их химического состава, которые могут влиять на растворимость, реакционную активность и корректность результатов.
Для анализа масел, которые часто содержат небольшое количество воды, но обладают низкой растворимостью в стандартных реактивах, можно использовать добавление до 30% хлороформа в титрационную ячейку. Хлороформ, как дополнительный растворитель, улучшает растворимость масла, обеспечивая более равномерное распределение воды в образце. Это позволяет воде активнее взаимодействовать с анолитом и повышает точность измерения.
Хлороформ добавляется в комбинации с основным растворителем, таким как метанол или этанол, создавая среду, в которой масла полностью растворяются и обеспечивают корректное взаимодействие воды с генерируемым йодом. Однако следует учитывать, что добавление хлороформа не должно превышать 30%, так как более высокая концентрация может нарушить работу ячейки и увеличить время титрования.
Альдегиды и кетоны требуют особого подхода из-за их химических свойств, таких как склонность к окислению. Метанол, часто используемый в стандартных анолитах, может вступать в побочные реакции с альдегидами и кетонами, что приведет к некорректным результатам. Для точного анализа данных соединений применяются безметанольные реактивы, специально разработанные для предотвращения побочных реакций и обеспечения полной специфичности по отношению к воде.
Безметанольные реактивы часто содержат заменители метанола, такие как этанол или другие спирты с минимальным влиянием на структуру альдегидов и кетонов. Эти реагенты позволяют избежать побочных продуктов и значительно повышают точность определения содержания воды в таких образцах.
Некоторые образцы содержат воду, которая трудно извлекается стандартными методами, или плохо растворяются в анолите. Для таких случаев требуются дополнительные этапы пробоподготовки перед введением в титрационную ячейку:
1. Метод экстракции: Этот метод подходит для образцов, в которых вода находится в связанной форме, либо для веществ с высоким содержанием масел, жиров или других трудно растворимых компонентов. С помощью экстракции воду можно освободить и перевести в растворимое состояние. Чаще всего для этого используются смеси растворителей, которые способны полностью захватить воду из образца.
2. Сушильная печь: Этот метод необходим для образцов с сильно связанной влагой, особенно в твердых веществах или порошках. Образец помещается в сушильную печь, где под воздействием высокой температуры вода испаряется, после чего пар попадает в приемную ячейку титратора, где и происходит измерение. Использование сушильной печи особенно эффективно для порошков, волокон, пленок и других твердых материалов, в которых вода остается в капиллярной форме.
Эти методы позволяют повысить точность анализа для образцов, которые трудно анализировать традиционным титрованием в ячейке.
Сервис автоматических титраторов
Мы оказываем полную поддержку на всех этапах установки и запуска в эксплуатацию, а также предлагаем дальнейшее сервисное обслуживание. Проводим настройку методик, диагностику, ремонт, квалификацию, обучение. Узнать подробнее
Проведем у Вас тренинг: Экспертное Титрование
Профессиональный тренинг для пользователей, желающих улучшить свои навыки в работе с автоматическими титраторами. Узнать подробнее
 POWER Full 14POWER Full 141000₽
POWER Full 14POWER Full 141000₽ POWER Full 14POWER Full 142000₽
POWER Full 14POWER Full 142000₽
Оставляя заявку, вы соглашаетесь на обработку персональных данных.