
Титрование кислот, определение коэффициента поправки, титра, расчет концентрации
Стандартизация титрованных растворов
Титрованными, стандартными или рабочими называются растворы точно известной концентрации, предназначенные для количественного определения веществ титриметрическими методами. Для определения концентрации кислоты в растворе используют титрование стандартным раствором гидроксида натрия или калия.
Приготовление и стандартизация титрованных растворов регламентируется ГОСТом 25794.1-83. Мы расмотрим более подробно наиболее часто используемый титрант 0,1 М раствор гидроксида натрия. Его можно приготовить, растворив 4 г NaOH в 1 л дистиллированной воды или используя фиксанал гидроксида натрия.
Установить нормальность раствора едкого натра можно и по рабочему стандартизированному раствору соляной кислоты или серной кислоты. Но титр данных растворов должен быть сам определен по какому-то первичному стандарту.
В качестве первичных стандартов для определения титра щелочи так же применяют янтарную кислоту, бензойную и щавелевую кислоту.
В настоящее время для установки титров стандартных растворов оснований все чаще стали применять бифталат калия. Это объясняется тем, что он вполне удовлетворяет требованиям, предъявляемым к установочным веществам. Установка титра (коэффициента поправки) 0,1 М раствора NaOH по бифталату калия (гидрофталат калия, калий фталевокислый, C8H5KO4,(М=204,22)).
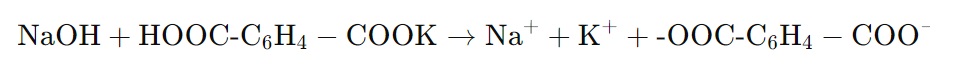
Для установления коэффициента поправки используют не менее трех навесок, взвешивая их (результат взвешивания в граммах записывают с точностью до четвертого знака). Навески 0,1-0,2 г, предварительно измельченного и высушенного при температуре 120 °С в течение 2 ч, растворяют в 50 мл дистиллированной воды.
Проводят потенциометрическое титрование на автоматическом титраторе с рН-электродом. Титруют до нахождения прибором точки эквивалентности. Титратор строит кривую титрования, пока кислоты много в растворе, он добавляет большими каплями, при приближении к точке эквивалентности размер капли уменьшается, для более точного определения конца титрования. При титровании до точки эквивалентности, титратор всегда перетитровывает раствор, для построения кривой титрования и ее производной. Максимум или минимум на кривой титрования соответствует точке эквивалентности.
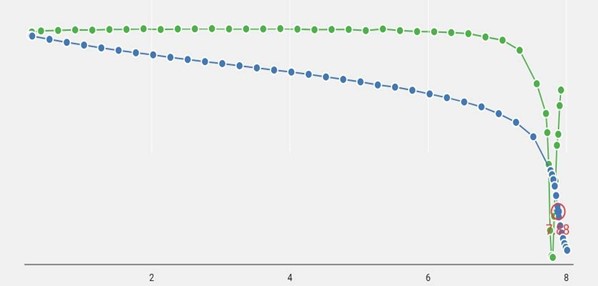
Рисунок 1. Кривая титрования гидрофталата калия 0.1 М раствором NaOH на потенциометрическом титраторе Титровойс Автоматик. Синим цветом отображена кривая титрования, зеленым ее производная.
Точную молярную концентрацию с, моль/л, с коэффициентом поправки вычисляют
по формуле:
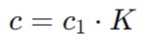
Где:
c — точная молярная концентрация вещества в растворе, моль/л;
c1 — заданная (номинальная) молярная концентрация вещества в растворе, моль/л;
K — коэффициент поправки, который учитывает погрешности или отклонения от номинальной концентрации.
Точную молярную концентрацию с, моль/л, без коэффициента поправки вычисляют
по формуле:
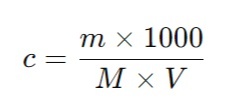
Где:
c — молярная концентрация вещества в растворе, моль/л;
m — масса навески установочного вещества, г;
M — молярная масса эквивалента установочного вещества, г/моль (для гидрофталата калия M=204.22 г/моль);
V — объем титранта, израсходованный на титрование, мл.
Точная молярная концентрация вещества в растворе выражается четырьмя значащими цифрами после запятой. При применении установочного вещества коэффициент поправки вычисляют по формуле:
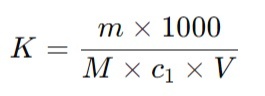
Где:
K — коэффициент поправки;
m — масса навески установочного вещества, г;
M — молярная масса эквивалента установочного вещества, г/моль;
c1 — заданная молярная концентрация вещества в растворе, моль/л;
V — объем титранта, израсходованный на титрование, мл.
При применении раствора установочного вещества (заданная молярная концентрация
обоих растворов одинаковая) коэффициент поправки вычисляют по формуле:
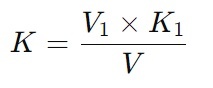
Где:
K — коэффициент поправки;
V1 — объем раствора установочного вещества, мл;
K1 — коэффициент установочного вещества;
V — объем раствора, израсходованный на титрование, мл.
Согласно ГОСТ 25794.1-83 коэффициент поправки вычисляют с точностью до четвертого десятичного знака по каждой навеске установочного вещества или по каждому объему раствора установочного вещества. Если расхождения между коэффициентами не превышают 0,001, берут среднее арифметическое из полученных результатов и рассчитывают К. Если расхождения между отдельными коэффициентами превышает 0,001, то титрование повторяют до тех пор, пока не будут получены сходимые результаты.Высокая точность приготовления титрованных растворов является необходимым условием высокой точности титриметрических способов количественного определения веществ.
Коэффициент поправки рекомендуется устанавливать при 20 °С, при этой же температуре применяют титрованные растворы. Коэффициент поправки проверяют не реже одиного раз в месяц, если раствор устойчив, соблюдены условия хранения. Титрованные растворы, в которых при хранении появились хлопья или осадок, не должны применяться.
Чтобы поддерживать титр гидроксида натрия постоянным, важно избегать попадания CO₂ из воздуха, что приводит к образованию карбоната натрия. Это достигается использованием подходящего адсорбирующего материала, например, гидроксида натрия на носителе. Он помещается в осушительный патрон сверху держателя бюретки.
У нас вы найдете широкий ассортимент автоматических титраторов. Мы предлагаем различные модели приборов, которые удовлетворят потребности как малых лабораторий, так и крупных производств. Наша команда профессионалов готова помочь вам настроить любые методы титрования, обеспечивая точность и надежность результатов. Если вы хотите узнать больше о моделях титраторов и их возможностях, свяжитесь с нами, и мы с радостью предоставим всю необходимую информацию! Узнать подробнее про модели титраторов.

Титрование сильных кислот
Сильные кислоты, такие как серная (H₂SO₄), соляная (HCl) и азотная (HNO₃), находят широкое применение в различных отраслях промышленности и науки. Серная кислота используется в производстве удобрений, взрывчатых веществ и как компонент в аккумуляторах автомобилей. Она также служит важным реагентом в химическом синтезе и очистке металлов. Соляная кислота находит применение в металлургии для удаления оксидов и в пищевой промышленности для регулирования кислотности и стерилизации.Азотная кислота используется в производстве взрывчатых веществ, таких как нитроглицерин и тротил, а также в производстве красителей и удобрений. Все эти кислоты играют ключевую роль в химической промышленности, где их сильные реакционные свойства и способность к диссоциации делают их незаменимыми для разнообразных процессов, от синтеза до очистки и анализа.
Титрование сильных кислот сильным основанием – это классический и широко применяемый метод кислотно-основного анализа, основанный на реакции нейтрализации. В современной аналитической химии для проведения таких титрований все чаще используются автоматические титраторы, которые обеспечивают высокую точность, повторяемость и автоматизацию процесса. При титровании сильных кислот сильным основанием (NaOH, KOH) происходит полная диссоциация как кислоты, так и основания в растворе, что приводит к простой стехиометрии реакции:
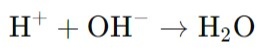
В эквивалентной точке количество добавленного основания полностью соответствует количеству кислоты в растворе, и система достигает состояния, в котором все ионы H⁺ нейтрализованы. Эквивалентная точка титрования определяется как момент, когда количество вещества основания эквивалентно количеству вещества кислоты. Для сильной кислоты и сильного основания эта точка находится при pH 7. Титраторы автоматически определяют точку эквивалентности, что исключает ошибки, связанные с визуальной оценкой изменения цвета индикатора.
Определение концентрации серной кислоты
Определение массовой доли серной кислоты (H₂SO₄) в растворе проводят титрованием раствором гидроксида натрия (NaOH). В зависимости от концентрации серной кислоты можно использовать различные концентрации щелочи, например 0,1 М для разбавленных и до 1 М для концентрированных. Химическая реакция между серной кислотой (H₂SO₄) и гидроксидом натрия (NaOH) — это реакция нейтрализации, которая протекает по следующей схеме:
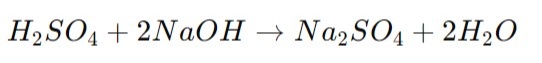
В этой реакции одна молекула серной кислоты реагирует с двумя молекулами гидроксида натрия, образуя сульфат натрия (Na₂SO₄) и воду (H₂O). Помещают в стаканчик аликвоту анализируемого раствора серной кислоты разбавляют дистиллированной водой так, чтобы электроды были погружены в раствор на 1,5–2 см. Если Ваш образец концентрированная серная кислота, ее необходимо сначала разбавить. Для безопасного разбавления концентрированной серной кислоты (H₂SO₄) сначала налейте необходимое количество дистиллированной воды в подходящую ёмкость. Затем медленно добавляйте концентрированную серную кислоту в воду, постоянно перемешивая стеклянной палочкой. Никогда не добавляйте воду в концентрированную серную кислоту, так как это может привести к бурной реакции и разбрызгиванию. При необходимости остудите раствор, если он сильно нагрелся. Работайте в защитной одежде и в хорошо вентилируемом помещении.
Титрование проводят не менее трех раз до получения сходящихся результатов. Концентрацию серной кислоты в моль/л рассчитывают по формуле:
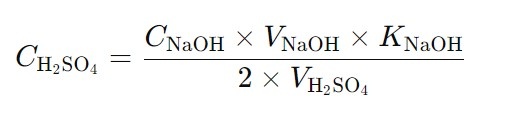
где:
C(H2SO4) — концентрация серной кислоты,
C(NaOH) — номинальная концентрация раствора гидроксида натрия,
V(NaOH) — объем раствора гидроксида натрия, пошедший на титрование, в мл,
K(NaOH) — коэффициент поправки для раствора гидроксида натрия,
V(H2SO4) — объем раствора серной кислоты, взятый для титрования, в мл.
Если необходимо рассчитать концентрацию серной кислоты в процентах, используя массу образца, формула с учетом коэффициента поправки для NaOH будет выглядеть следующим образом:
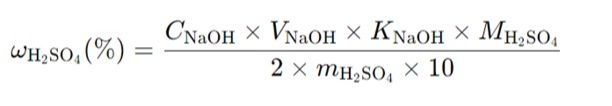
Где:
ω(H2SO4) — массовая доля серной кислоты, %.
V(NaOH) — объем раствора NaOH, израсходованный на титрование, мл.
C(NaOH) — концентрация раствора NaOH, моль/л.
K(NaOH) — коэффициент поправки для раствора NaOH,
M(H2SO4) — молекулярная масса серной кислоты (98,08 г/моль).
m(H2SO4)— масса образца серной кислоты, г.
2 — коэффициент стехиометрии реакции.
10 — коэффициент для приведения единиц в правильный формат
Титрование соляной кислоты
Титрование соляной кислоты (HCl) обычно проводится с использованием раствора гидроксида натрия (NaOH) в качестве титранта. Для разбавленных растворов соляной кислоты (например, концентрация HCl ≈ 0.1 М) используют титрант NaOH с концентрацией 0.1 М. Для концентрированных растворов HCl, таких как HCl с концентрации 1 М, применяют титрант NaOH с концентрацией 1 М.
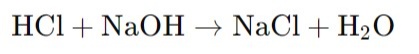
Для расчета концентрации соляной кислоты в процентах с учетом коэффициента поправки, используйте следующую формулу:
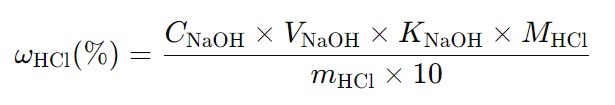
где:
ω(HCl)— массовая доля соляной кислоты в процентах,
C(NaOH) — номинальная концентрация раствора NaOH (моль/л),
V(NaOH) — объем раствора NaOH, использованный для титрования, в мл,
K(NaOH) — коэффициент поправки для раствора NaOH,
M(HCl) — молекулярная масса соляной кислоты (36,46 г/моль),
m(HCl) — масса образца соляной кислоты, взятого для титрования, в г,
10 — коэффициент для перевода результата в проценты.
За результат анализа принимают среднеарифметическое двух параллельных определений, расхождение между которыми не превышает допускаемое, равное 0,3 %.
Титровойс Автоматик — современный автоматический титратор российского производства, разработанный для автоматизации потенциометрического титрования. Этот титратор идеально подходит для выполнения ежедневных рутинных анализов, сочетая простоту и удобство в использовании. Узнать подробнее.

Титрование слабых кислот
Слабые кислоты, такие как уксусная, лимонная, молочная и другие, играют важную роль в химии и различных отраслях промышленности. Уксусная кислота (CH₃COOH) — распространённая кислота, которую можно найти в уксусе и которая активно используется в кулинарии и химических реакциях. Лимонная кислота (C₆H₈O₇) присутствует в цитрусовых фруктах, таких как лимоны и апельсины, и применяется в пищевой промышленности и как антисептик. Лимонная кислота часто используется в производстве соков для регулирования кислотности, улучшения вкуса и продления срока хранения. Молочная кислота (CH₃CH(OH)COOH) образуется в процессе молочнокислого брожения и содержится в йогурте и кефире. Муравьиная кислота (HCOOH), также известная как формальдегидная кислота, является одной из самых простых карбоновых кислот. Она получила свое название из-за ее присутствия в муравьях, где она образуется как побочный продукт метаболизма. В промышленности она применяется как консервант, антисептик и в производстве красителей. В сельском хозяйстве используется для борьбы с паразитами и в качестве средства для сохранения кормов. Тартратная кислота (C₄H₄O₆), более известная как винная кислота, содержится в винограде и используется в пищевой промышленности в качестве разрыхлителя. Оксаловая кислота (C₂H₂O₄), также известная как щавелевая кислота, присутствует в растениях, таких как шпинат и ревень, и используется в химическом анализе и как очиститель.
Титрование слабых кислот представляет собой процесс количественного анализа, используемый для определения их концентрации в растворе. В отличие от сильных кислот, слабые кислоты не диссоциируют полностью в воде, что влияет на процесс титрования и интерпретацию результатов.Слабые кислоты частично диссоциируют в водном растворе, создавая равновесие между неионезированной кислотой и ее ионами. Например, уксусная кислота (CH₃COOH) диссоциирует в воде следующим образом:
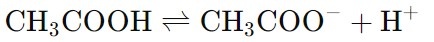
В титровании слабых кислот обычно используют раствор сильного основания, такого как NaOH. Поскольку слабые кислоты частично диссоциируют, точка эквивалентности титрования не будет нейтральной (pH 7). Вместо этого, pH в точке эквивалентности будет зависеть от силы кислоты и основания. В близи точки эквивалентности слабые кислоты могут образовывать буферные растворы, что делает изменение pH менее резким. Это следует учитывать при интерпретации результатов. Для определения концентрации слабой кислоты в моль/л с использованием титрования можно использовать следующую общую формулу:
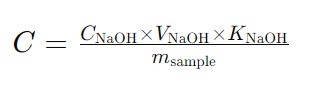
C — концентрация слабой кислоты в растворе (моль/л),
C(NaOH) — концентрация раствора гидроксида натрия (моль/л),
V(NaOH) — объем раствора гидроксида натрия, использованный для титрования (мл),
K(NaOH) — коэффициент поправки для раствора NaOH,
m sample — масса образца в граммах (г).
Для расчета концентрации слабой кислоты в процентах используйте следующую формулу:
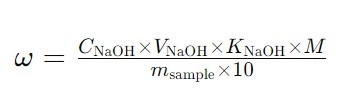
M — молекулярная масса кислоты (г/моль),
Молекулярные массы слабых кислот:
Уксусная кислота (CH₃COOH): 60.05 г/моль.
Лимонная кислота (C₆H₈O₇): 192.13 г/моль.
Щавелевая кислота (H₂C₂O₄): 90.03 г/моль.
Винная кислота (C₄H₆O₆): 150.09 г/моль.
Муравьиная кислота (HCOOH): 46.03 г/моль.
Титрование смеси сильной и слабой кислот
При титровании смеси сильной и слабой кислот существуют два основных метода: раздельное и совместное титрование, которые зависят от разницы в константах диссоциации кислот. Вот ключевые особенности каждого метода:
Раздельное титрование
Условия для раздельного титрования:
Константы диссоциации кислот должны различаться по крайней мере на порядок 10^4 (то есть одна кислота значительно сильнее другой).
Константы диссоциации должны быть не менее 10^−7.
Процесс:
Титрование сильной кислоты: Сначала титруется более сильная кислота. На кривой титрования будет заметен отчетливый скачок pH, когда сильная кислота полностью нейтрализована. Этот скачок обычно происходит при низком pH.
Титрование слабой кислоты: После нейтрализации сильной кислоты титруется слабая кислота. В этом случае на кривой титрования появится второй скачок pH, который происходит при более высоком pH, поскольку слабая кислота диссоциирует менее эффективно.
Кривая титрования выглядит как два четко разделенных скачка pH, соответствующих эквивалентным точкам титрования каждой кислоты.
Совместное титрование
Условия для совместного титрования:
Отношение констант диссоциации кислот менее 10^4, то есть разница в силе кислот недостаточно велика для их раздельного титрования.
Процесс:
Суммарное титрование: При добавлении титранта к смеси кислот будет наблюдаться один основной скачок pH на кривой титрования, соответствующий суммарному титрованию всех присутствующих кислот.
Кривая титрования представляет собой совмещение кривых титрования для каждой кислоты. Вначале титруется более сильная кислота, и этот процесс будет виден как первый скачок. После нейтрализации сильной кислоты титруется слабая кислота, что проявляется как постепенное изменение pH без резкого скачка.
Кривая титрования:
В случае совместного титрования кривая будет показывать один переход от более низкого pH (для сильной кислоты) к более высокому pH (для слабой кислоты), часто с плавным переходом между ними.
Форма кривой титрования смеси сильной и слабой кислот в значительной мере зависит от силы слабой кислоты. Для наглядности рассмотрим это на графике
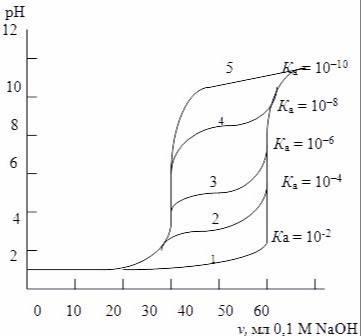
Рисунок 2. Кривые титрования смесей сильной и слабой кислот с различными Ка
Если константа ионизации слабой кислоты относительно велика (кривая 1), скачок на кривой титрования в 1-й точке эквивалентности практически отсутствует. Для таких смесей на основе результатов титрования по 2-му скачку можно определить только общую кислотность (т.е. НСl + НА). Один скачок на кривой титрования смеси сильной и слабой кислот будет наблюдаться и в том случае, когда константа ионизации слабой кислоты НА очень мала (Ка <1×10-8). В этом случае условие КасНА >= 1×10-8 не выполняется, и титроваться будет только сильная кислота.
При титровании смеси сильной и слабой кислот с промежуточными значениями Ка (4 <= рКа <= 8) на кривой титрования наблюдаются два скачка. Возможно также раздельное титрование смеси сильного и слабого основания при условии, что Кb <= 10-4. Расчет кривой титрования такой смеси аналогичен рассмотренному для смеси сильной и слабой кислот.
Сервис автоматических титраторов
Мы оказываем полную поддержку на всех этапах установки и запуска в эксплуатацию, а также предлагаем дальнейшее сервисное обслуживание. Проводим настройку методик, диагностику, ремонт, квалификацию, обучение. Узнать подробнее
Проведем у Вас тренинг: Экспертное Титрование
Профессиональный тренинг для пользователей, желающих улучшить свои навыки в работе с автоматическими титраторами. Узнать подробнее
 POWER Full 14POWER Full 141000₽
POWER Full 14POWER Full 141000₽ POWER Full 14POWER Full 142000₽
POWER Full 14POWER Full 142000₽
Оставляя заявку, вы соглашаетесь на обработку персональных данных.