
Титриметрические методы анализа воды: принципы и применение
Введение
Анализ химического состава воды играет ключевую роль в различных отраслях – от экологического мониторинга до фармацевтического и промышленного производства. Контроль качества воды необходим для обеспечения безопасности питьевой воды, оптимизации технологических процессов, оценки степени загрязнения сточных вод и контроля состава лабораторных и фармацевтических растворов.
Титриметрический метод остается одним из наиболее точных и надежных способов определения различных компонентов воды. Он позволяет количественно определить жесткость, содержание кальция и магния, концентрацию карбонатов и гидрокарбонатов, хлоридов и степень органического загрязнения (перманганатную окисляемость). Этот метод широко применяется благодаря высокой воспроизводимости, доступности реактивов и возможности автоматизации процесса.
В зависимости от типа воды применяются различные методики анализа:
Питьевая вода. Контроль качества питьевой воды – одна из важнейших задач санитарно-гигиенического контроля, так как вода напрямую влияет на здоровье человека. Одним из ключевых параметров является жесткость воды, определяемая содержанием кальция и магния. Избыточная жесткость может вызывать образование накипи в бытовых приборах и системах водоснабжения, а также негативно сказываться на вкусовых свойствах воды. Помимо этого, важен контроль содержания хлоридов, которые могут попадать в воду из природных источников, а также в результате процессов очистки и обеззараживания. Превышение допустимых норм хлоридов ухудшает вкусовые качества воды и может негативно влиять на здоровье человека при длительном употреблении.
Промышленная и технологическая вода. Вода, используемая в промышленных процессах, должна соответствовать строгим требованиям, поскольку ее химический состав влияет на долговечность оборудования, эффективность технологических процессов и качество конечной продукции. Например, в теплоэнергетике контроль карбонатов и гидрокарбонатов необходим для предотвращения образования накипи в котлах и трубопроводах, что может привести к снижению теплопередачи и увеличению энергозатрат. В химической и металлургической промышленности важно контролировать жесткость воды и содержание хлоридов, так как высокая концентрация этих соединений может ускорять коррозионные процессы, снижая срок службы оборудования.
Отработанные сточные воды. Анализ сточных вод необходим для оценки уровня загрязнения и соблюдения экологических стандартов. В сточных водах промышленных предприятий часто присутствуют высокие концентрации органических веществ, тяжелых металлов, хлоридов и других загрязнителей, способных нанести вред окружающей среде. Одним из ключевых показателей качества сточных вод является перманганатная окисляемость – она отражает содержание легкоокисляемых органических соединений, что позволяет оценить уровень загрязнения. Также важно контролировать карбонаты и гидрокарбонаты, которые могут влиять на кислотно-щелочной баланс воды, а также определять хлориды, избыток которых приводит к засолению почв и ухудшению состояния водоемов. Для очистки сточных вод необходимо строго контролировать их химический состав, что позволяет минимизировать негативное воздействие на природу и снизить затраты на водоподготовку.
Лабораторные и фармацевтические растворы. Вода, используемая в лабораториях и фармацевтическом производстве, должна соответствовать жестким стандартам чистоты, поскольку даже минимальные примеси могут повлиять на результаты исследований и качество лекарственных препаратов. Например, в аналитической химии важно использовать воду с низким содержанием растворенных солей, чтобы исключить влияние посторонних примесей на измерения. В фармацевтическом производстве жесткость воды, содержание карбонатов и гидрокарбонатов контролируются для предотвращения образования осадков в растворах и обеспечения стабильности лекарственных средств.
Современные автоматические титраторы значительно упрощают процесс анализа, обеспечивая высокую точность, воспроизводимость и снижение влияния человеческого фактора. Использование автоматизированных систем позволяет ускорить проведение исследований, минимизировать расход реагентов и повысить достоверность результатов, что особенно важно в лабораториях с высоким объемом анализируемых проб. Благодаря автоматическим титраторам контроль качества воды становится более эффективным, что особенно актуально для предприятий, работающих с большими объемами проб и требующих высокой точности аналитических данных.
Определение общей жесткости воды и определение кальция и магния
Жесткость воды — это важный параметр, который характеризует ее качество и определяется наличием растворенных солей щелочно-земельных металлов, в первую очередь ионов кальция (Ca²⁺) и магния (Mg²⁺). Вода, содержащая эти ионы, может вызывать различные проблемы как в бытовом, так и в промышленном использовании. Согласно стандартам, таким как ГОСТ 31954-2012 "Вода питьевая. Методы определения жесткости" и РД 52.24.395-2007 "Жесткость воды. Методика выполнения измерений титриметрическим методом с Трилоном Б", жесткость подразделяется на кальциевую и магниевую, в зависимости от преобладания соответствующих ионов.
Общая жесткость воды делится на карбонатную и некарбонатную. Карбонатная жесткость обусловлена наличием гидрокарбонатов и карбонатов кальция и магния. Этот тип жесткости также называется временной, так как он может быть устранен при кипячении воды. При длительном кипячении гидрокарбонаты разлагаются, выделяя углекислый газ, и образуются осадки карбонатов кальция и магния:
Ca(HCO3)2→CaCO3↓+CO2+H2O
Mg(HCO3)2→MgCO3↓+CO2+H2O
Некарбонатная жесткость, или постоянная жесткость, связана с наличием солей кальция и магния, таких как сульфаты и хлориды, которые не устраняются при кипячении. Эта часть жесткости сохраняется после обработки воды, так как ионы кальция и магния все равно присутствуют в растворенном состоянии.
Постоянная жесткость является важной характеристикой качества воды, используемой для технических целей, поскольку она может влиять на работу котлов и других устройств, где требуется теплообмен. Сульфаты и хлориды, присутствующие в воде, могут образовывать прочные накипи на поверхности нагревательных элементов, что приводит к снижению их теплопроводности и увеличению расхода топлива.
Кроме того, высокая жесткость, особенно обусловленная превышением солей магния, может ухудшать органолептические свойства воды, придавая ей горьковатый вкус и оказывая негативное влияние на органы пищеварения. Для питьевых вод предельно допустимая величина жесткости составляет 7 ммоль/дм³ по кальций-углеродному эквиваленту (КВЭ), но в некоторых случаях допускается использование воды с жесткостью до 10 ммоль/дм³ КВЭ.
Определение жесткости воды, а также содержания кальция и магния, осуществляется титриметрическим методом с использованием Трилона Б (EDTA). Этот метод позволяет точно и быстро получить данные о содержании указанных ионов в пробе воды. Подобный подход является стандартной практикой для лабораторий, работающих с анализом воды, обеспечивая высокую точность и воспроизводимость результатов.
При необходимости устранения жесткости воды применяются различные методы, такие как осаждение труднорастворимых солей кальция и магния химическим или термическим путем, а также умягчение с помощью ионитов. Эти процессы позволяют улучшить качество воды и предотвратить образование накипи, что особенно важно в промышленных системах водоснабжения и в бытовых условиях.
Раздельное определение кальция и магния
Метод позволяет определить кальций и магний отдельно за счет разной селективности индикаторов и различий в условиях титрования:
Эриохром черный Т:
Этот индикатор используется для определения общей жесткости, которая включает сумму ионов кальция и магния. Эриохром черный Т взаимодействует с магнием, образуя красно-фиолетовый комплекс. При титровании с ЭДТА (этилендиаминтетрауксусная кислота) происходит изменение цвета раствора: в точке эквивалентности, когда Mg²⁺ полностью связывается с ЭДТА, цвет меняется с красно-фиолетового на синий. Это изменение цвета фиксируется фотометрическим датчиком, что позволяет точно определить момент достижения точки эквивалентности.Мурексид:
Этот индикатор используется для раздельного определения ионов кальция. В присутствии Ca²⁺ мурексид образует розово-фиолетовый комплекс, который при титровании с ЭДТА переходит в фиолетово-синий цвет. Различие в селективности индикаторов и условиях титрования позволяет отделить анализ кальция и магния.

Процессы титрования
Определение кальция:
Титрование проводится при pH ~12 в присутствии мурексида. При таком уровне pH магний выпадает в осадок в виде Mg(OH)₂, и титруется только кальций. В точке эквивалентности цвет раствора изменяется с розово-фиолетового на синий, что сигнализирует о полном связывании кальция с ЭДТА.Определение общей жесткости (Ca²⁺ + Mg²⁺):
Для определения общей жесткости титрование проводят при pH 10 с использованием эриохрома черного Т. В начале титрования раствор имеет винно-красный цвет (из-за комплекса Mg²⁺ с индикатором). По мере добавления ЭДТА и связывания ионов кальция и магния цвет раствора меняется на синий.Расчет содержания магния:
Концентрация Mg²⁺ может быть вычислена как разница между общей жесткостью и содержанием кальция, полученным в результате титрования.
Преимущества автоматических титраторов с фотометрическими датчиками
Автоматические титраторы, оснащенные фотометрическими датчиками, представляют собой современное решение для точного и эффективного анализа состава растворов. Они обеспечивают автоматизацию процесса титрования, что особенно важно при индикаторном титровании. Фотометрический датчик измеряет изменение окраски раствора во время титрования. В процессе титрования изменение концентрации окрашенного комплекса влияет на светопропускание раствора. Датчик фиксирует изменения интенсивности света и строит кривую титрования, что позволяет автоматически определить момент, когда достигнута точка эквивалентности.
Автоматические титраторы обеспечивают исключение субъективных ошибок, которые могут возникнуть при визуальной оценке изменения цвета раствора. Это особенно важно, так как разные люди могут по-разному воспринимать цвета, что влияет на точность результатов. Использование фотометрических датчиков позволяет точно определить момент перехода окраски, даже если изменение цвета является размытым.
У нас вы найдете широкий ассортимент автоматических титраторов. Мы предлагаем различные модели приборов, которые удовлетворят потребности как малых лабораторий, так и крупных производств. Наша команда профессионалов готова помочь вам настроить любые методы титрования, обеспечивая точность и надежность результатов. Если вы хотите узнать больше о моделях титраторов и их возможностях, свяжитесь с нами, и мы с радостью предоставим всю необходимую информацию! Узнать подробнее про модели титраторов.

Содержание хлоридов в воде
Хлориды являются важными ионами, которые встречаются в природных водах всех типов. В зависимости от источников поступления и условий окружающей среды, их содержание может значительно варьироваться. В частности, в речных и озерных водах концентрации хлоридов колеблются от долей миллиграмма до нескольких граммов на кубический дециметр. В морских и океанских водах, а также в некоторых подземных источниках и соляных озерах содержание хлоридов может достигать значительно более высоких значений, иногда вплоть до перенасыщенных растворов.
Хлориды, как правило, обладают высокой растворимостью в воде, не склонны к образованию ионных пар и имеют хорошую миграционную способность. Это обусловлено их низкой способностью к сорбции на взвешенных частицах и донных отложениях, а также отсутствием накопления в организмах водных животных.
Повышенное содержание хлоридов в воде негативно сказывается на её вкусовых качествах, делая её непригодной для питьевого водоснабжения. Кроме того, высокие концентрации хлоридов могут затруднить использование воды для технических и хозяйственных нужд, а также для орошения сельскохозяйственных земель.
В соответствии с нормативными требованиями, предельно допустимая концентрация хлоридов в питьевой воде составляет 350 мг/дм³, в то время как для вод, используемых в рыбном хозяйстве, этот показатель равен 300 мг/дм³. Эти лимиты установлены для защиты здоровья населения и сохранения экосистемы водоемов.
Метод определения содержания хлоридов
Содержание хлоридов в питьевой воде определяется методом аргентометрии, описанным в ГОСТ 4245-72 и РД 52.24.407-2006. Данные методы основан на осаждении ионов хлора в нейтральной или слабощелочной среде с использованием раствора нитрата серебра.
Принцип метода
Подготовка пробы: Для начала к пробе воды добавляется небольшое количество азотной кислоты для создания кислой среды. Это необходимо для предотвращения образования осадков других солей ионов, таких как карбонаты или гидрокарбонаты, которые могут повлиять на точность измерений.
Титрование: Затем происходит титрование хлорид-ионов раствором нитрата серебра (AgNO₃). В процессе титрования ионы хлора реагируют с нитратом серебра, образуя нерастворимый осадок хлорида серебра (AgCl):
Ag + Cl− → AgCl↓
Измерение и расчет: После завершения титрования измеряется количество добавленного раствора нитрата серебра, что позволяет вычислить содержание хлоридов в пробе. Это может быть выполнено с использованием автоматического титраторас серебряным электродом, который обеспечивает точные и воспроизводимые результаты.
Этот метод позволяет определить концентрацию хлоридов в воде с высокой точностью и минимизирует влияние субъективных факторов, связанных с визуальной оценкой.
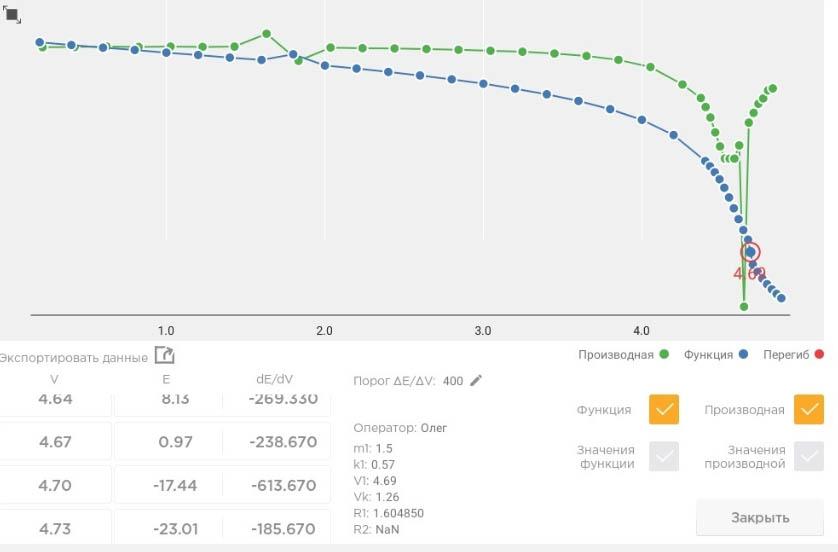
Кривая титрования хлоридов полученная на титрвторе Титровойс Автоматик.
Методы определения щелочности и массовой концентрации карбонатов и гидрокарбонатов
Содержание щелочности и массовая концентрация карбонатов и гидрокарбонатов в воде определяются согласно ГОСТ Р 52963—2008, ГОСТ 31957-2012 и РД 52.24.493-2006. Эти методики включают титриметрический метод, который позволяет получить важные характеристики химического состава вод.
Щелочность воды
Щелочность является одной из важнейших характеристик поверхностных вод суши, определяющей геохимические и гидрохимические процессы, влияющие на формирование химического состава вод, эрозию земной поверхности и образование осадочных пород. Величина щелочности используется для расчета компонентов карбонатного равновесия и угольной кислоты, что необходимо при исследовании состояния водных экосистем.
Существует три формы щелочности:
Свободная щелочность — определяется количеством кислоты, необходимой для титрования пробы воды до pH 8,3. Она обусловлена присутствием в воде гидроксильных и карбонатных ионов.
Карбонатная щелочность — определяется количеством кислоты, необходимой для перевода карбонатов и гидрокарбонатов в угольную кислоту. Точка эквивалентности при титровании без удаления диоксида углерода соответствует pH около 4,5.
Общая щелочность — характеризует общее содержание в воде анионов слабых органических и неорганических кислот и гидроксильных ионов, титруемых сильной кислотой.
В поверхностных водах карбонатная щелочность, как правило, преобладает и часто принимается равной общей щелочности. В загрязненных водах, особенно в сточных, заметный вклад в общую щелочность могут вносить другие основания, такие как фосфаты, силикаты и гуматы.
Концентрация карбонатов и гидрокарбонатов
Карбонаты, гидрокарбонаты и свободный диоксид углерода являются формами угольной кислоты в поверхностных водах. Количественные соотношения между ними зависят от состояния карбонатно-кальциевой системы и величины pH:
Гидрокарбонаты преобладают в интервале pH 6,0-10,0, с максимальным содержанием при pH 8,3-8,4.
Карбонаты начинают доминировать при pH выше 7 и становятся главной формой производных угольной кислоты при pH выше 10,5.
Основные источники поступления карбонатов и гидрокарбонатов в поверхностные воды — это химическое выветривание и растворение карбонатных пород, а также сточные воды промышленных предприятий. Концентрация гидрокарбонатов в поверхностных водах может колебаться от 10-20 мг/дм³ до 400-500 мг/дм³ и подвержена сезонным изменениям.
Методы титрования
При определении щелочности и концентрации карбонатов и гидрокарбонатов применяются два метода титрования:
Метод А — используется для определения свободной и общей щелочности питьевой воды, включая расфасованную (не газированную) и природную воду. Титрование проводится до pH 8,3 и 4,5, с использованием полученных значений для расчета массовых концентраций карбонатов и гидрокарбонатов.
Метод Б — предназначен для определения карбонатной щелочности питьевой и природной воды, а также воды, контролируемой на стадиях технологических процессов водоподготовки. Титрование пробы проводится до pH 5,4.
Эти методы обеспечивают точные и надежные результаты, позволяя оценить состояние водных ресурсов и их пригодность для различных хозяйственных нужд.
Метод определения перманганатной окисляемости воды
Метод определения перманганатной окисляемости воды описан в ГОСТ Р 55684-2013, ПНДФ 14.1:2:4.154-99 и предназначен для анализа проб питьевых, природных и сточных вод с использованием титриметрического метода. Данная методика допущена для целей государственного экологического контроля и применяется для определения перманганатного индекса в диапазоне от 0,25 до 100 мг/дм³ в расчете на атомарный кислород.
Перманганатная окисляемость определяет количество кислорода, потребляемого при химическом окислении органических и неорганических веществ в воде с помощью раствора перманганата калия в кислой среде. Метод может быть использован для анализа различных типов воды, включая:
Питьевую воду (в том числе расфасованную в емкости);
Природную воду (поверхностные и подземные источники);
Сточные воды (включая очищенные и ливневые);
Воду бассейнов и аквапарков;
Воду горячего водоснабжения.
Важно отметить, что метод применим для вод с содержанием хлорид-ионов менее 300 мг/дм³.
Принцип метода
Перманганатная окисляемость отражает общее содержание органических веществ в воде, так как окисляемые неорганические вещества обычно присутствуют в незначительных количествах. На значение перманганатного индекса могут влиять такие вещества, как:
Железо (II);
Сероводород;
Нитриты.
Если необходимо определить содержание только органических веществ, то при расчете итогового результата следует учитывать содержание восстанавливающих веществ. Для этого железо (II), сероводород и нитриты определяются отдельно, и их вклад в окисляемость вычитается из значения, полученного при титровании.
Процедура определения
Процесс определения перманганатной окисляемости включает следующие этапы:
Подготовка пробы: Пробу воды помещают в колбу и подкисляют серной кислотой.
Кипячение: Добавляют известное количество раствора перманганата калия и кипятят в течение 10 минут. В этом процессе происходит окисление присутствующих в пробе веществ.
Определение избытка перманганата: После кипячения оставшийся нерастворенный перманганат восстанавливается щавелевой кислотой.
Титрование: Избыток щавелевой кислоты отгитровывается раствором перманганата калия, что позволяет определить количество потребленного кислорода и, соответственно, перманганатную окисляемость.
Одновременно с каждой серией проб проводят холостое определение, используя дистиллированную воды, которую анализируют так же, как пробу воды
Этот метод позволяет точно оценить общее содержание органических веществ в воде, что является важным показателем для определения её качества и пригодности для различных целей.
Мы предлагаем автоматические титраторы для выполнения методик титрования, включая определение хлоридов, жесткости, карбонатов и перманганатной окисляемости. Осуществляем настройку оборудования и обучение персонала для эффективной и точной работы. Обратитесь к нам для подбора оптимального решения!
Какой титратор выбрать под ваши задачи?
Свяжитесь с нами и мы поможем подобрать оптимальное решение для вашей лаборатории! Заполнить заявку.
Сервис автоматических титраторов
Мы оказываем полную поддержку на всех этапах установки и запуска в эксплуатацию, а также предлагаем дальнейшее сервисное обслуживание. Проводим настройку методик, диагностику, ремонт, квалификацию, обучение. Узнать подробнее
 POWER Full 14POWER Full 141000₽
POWER Full 14POWER Full 141000₽ POWER Full 14POWER Full 142000₽
POWER Full 14POWER Full 142000₽
Оставляя заявку, вы соглашаетесь на обработку персональных данных.