
Основные Типы Титриметрических Реакций
Введение
Титрование является одним из наиболее распространенных методов количественного анализа в химии, который позволяет определить концентрацию вещества в растворе. Титриметрия, титриметрический анализ – метод количественного химического анализа, основанный на точном измерении объёма стандартного (титрованного) раствора, израсходованного на реакцию с определяемым веществом. Стандартным или титрованным называется раствор реактива точно известной концентрации, предназначенный для титриметрического анализа.
Типы реакций
Титриметрические методы анализа классифицируют:
1. В зависимости от способа титрования;
2. В зависимости от типа химической реакции, протекающей между веществами испытуемого и титрованного растворов.
В зависимости от способа титрования выделяют три основных вида: прямое, обратное и косвенное (заместительное) титрование.
Прямое титрование.
Прямое титрование — это метод, при котором раствор, содержащий определяемое вещество, титруется стандартным раствором до достижения точки эквивалентности. Количество определяемого вещества рассчитывается на основе объёма и молярности титрованного раствора, а также титра определяемого вещества.
Обратное титрование
При обратном титровании, также известном как титрование по остатку, используются испытуемый раствор и два стандартных раствора. Один из них является вспомогательным, а второй (основной) используется для непосредственного титрования. К точно измеренному объёму испытуемого раствора добавляется избыточный, но точно отмеренный объём первого титрованного раствора. В результате химической реакции определяемое вещество полностью расходуется, взаимодействуя с первым титрованным раствором. Второй титрованный раствор используется для титрования избытка первого вспомогательного титрованного раствора, который не вступил в реакцию с определяемым веществом. Количество определяемого вещества вычисляется на основе разности объёмов титрованных растворов с учётом контрольного опыта, молярности растворов и титра определяемого вещества по вспомогательному титрованному раствору.
Косвенное титрование
В косвенном (заместительном) титровании также используются испытуемый раствор и два титрованных раствора. К точно отмеренному объёму испытуемого раствора с определяемым веществом добавляется избыток первого (вспомогательного) титрованного раствора. Вещество в испытуемом растворе полностью расходуется в результате реакции, образуя эквивалентное количество соответствующего продукта реакции. Этот продукт реакции затем титруют вторым (основным) титрованным раствором до наступления точки эквивалентности. Таким образом, определяемое вещество заменяется другим веществом, которое затем подвергается анализу. Заместительное титрование применяется, когда невозможно определить вещество в испытуемом растворе, например, если нет подходящего титрованного раствора или невозможно установить точку эквивалентности. Количество определяемого вещества также рассчитывается, как и при прямом титровании.
Во многих случаях в титриметрии, независимо от способа титрования, требуется проведение контрольного (холостого) опыта. Это необходимо для устранения влияния примесей, используемых реактивов, неточностей, связанных с применением мерной посуды, условий определения, обусловленных побочными реакциями и другими причинами. В контрольном опыте участвуют все реактивы, кроме анализируемого вещества, или реактивы и анализируемое вещество без характерного реактива на анализируемое вещество. Контрольный опыт проводят параллельно с испытуемым образцом и в аналогичных условиях. Количество титрованного раствора, израсходованное на контрольный опыт, вычитают из общего количества титрованного раствора, пошедшего на титрование испытуемого раствора.
В зависимости от типа химической реакции, протекающей между веществами испытуемого и титрованного растворов различают несколько типов титриметрических реакций, каждая из которых используется для специфических целей и основана на различных химических процессах. Существует следующие типы титрования: кислотно-основное, окислительно-восстановительное, комплексонометрическое и осадительное.
Кислотно-основное титрование
Кислотно-основное титрование основано на реакции нейтрализации между кислотой и основанием. Этот метод широко применяется для определения концентрации кислот или оснований в растворе. В зависимости от используемых титрованных растворов различают разновидности кислотно-основного титрования:
- алкалиметрия – титрованными растворами являются растворы сильных оснований, например, натрия гидроксида, калия гидроксида и др.;
- ацидиметрия – титрованными растворами являются растворы сильных кислот, например, хлористоводородной кислоты, серной кислоты и др.
Для фиксирования конечной точки титрования применяют кислотно-основные индикаторы, способные изменять цвет в растворе в зависимости от рН раствора. Интервал перехода окраски индикатора должен находиться вблизи точки эквивалентности. Более удобным и точным является потенциометрическое титрования с использованием автоматического титратора с рН-электродом, при котором титратор рисует титриметрическую кривую и автоматически находит точку перегиба (эквивалентности).
Пример реакции:
Титрование раствора соляной кислоты (HCl) раствором гидроксида натрия (NaOH):
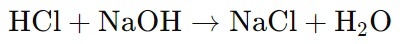
Титрование кислот и оснований в водных растворах
При титровании кислоты HA сильным основанием (например, NaOH) происходят две основные химические реакции:
1. HA + H₂O ⇌ H₃O⁺ + A⁻
2. 2 H₂O ⇌ H₃O⁺ + OH⁻
Эти кислотно-основные реакции протекают очень быстро, и равновесие устанавливается практически мгновенно. Благодаря этому титрование кислот и оснований в водных растворах является особенно удобным методом. Если растворы не слишком разбавлены, форма кривых титрования зависит главным образом от константы кислотности (Ka), как показано на приведённом ниже графике.
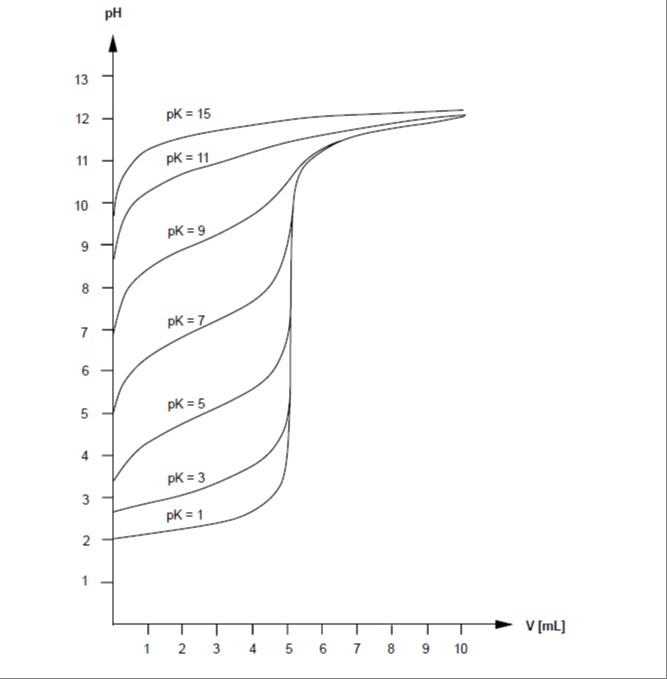
Примечания:
– Титрование очень слабых кислот в водных растворах затруднено. Из графика видно, что при значениях pKa больше 10 кривая титрования практически не демонстрирует скачка в области точки эквивалентности.
– Основания можно титровать сильной кислотой аналогично кислотам. При этом, если заменить константу кислотности Ka на константу основности Kb, а pH на pOH (pH + pOH = pKw = 14), титрационные кривые будут идентичными.
– Полипротонные кислоты (например, ортофосфорная кислота, которая ионизируется в несколько ступеней) и смеси кислот можно легко титровать по отдельности, если их константы кислотности отличаются хотя бы на два порядка pKa.
Кислотно-основное титрование в неводных растворах
Кислотно-основное титрование традиционно проводится в водных растворах, однако в ряде случаев использование неводных растворителей предоставляет значительные преимущества. Применение неводных сред становится актуальным, если:
- Анализируемое вещество плохо растворяется в воде.
- Анализируемое вещество или титрант могут вступать в нежелательные реакции с водой, например, если они содержат активные функциональные группы, такие как хлорангидриды или ангидриды кислот.
- В растворе присутствует смесь веществ, которую невозможно селективно проанализировать в воде из-за слишком близких значений pKa.
- Анализируемое вещество является слишком слабой кислотой или основанием для эффективного анализа в водной среде.
Основное применение неводных растворителей связано с кислотно-основными титрованиями, поскольку они позволяют проводить анализ в условиях, недоступных для водных систем. Подобно воде, каждый подходящий неводный растворитель может выполнять двойную функцию — действовать как кислота и как основание:
- Кислотные свойства растворителя описываются реакцией:
HS ⇌ H⁺ + S⁻
- Основные свойства описываются реакцией:
HS + H⁺ ⇌ SH₂⁺
Общая характеристика растворителя определяется константой автопротолиза (Ks), которая описывает способность молекул растворителя к протон-донорным и протон-акцепторным реакциям:
2 HS ⇌ SH₂⁺ + S⁻
Растворитель можно охарактеризовать тремя важными параметрами:
- Константа кислотности (Ka) — описывает его кислотные свойства.
- Константа основности (Kb) — определяет его основные свойства.
- Константа автопротолиза (Ks) — характеризует способность растворителя к самоионизации.
Выбор подходящего неводного растворителя играет ключевую роль для успешного проведения титрования. Важно учитывать следующие моменты:
1. Если определяемая кислота является очень слабой, растворитель должен иметь менее выраженные кислотные свойства, чем вода (низкая Ka). Это необходимо для того, чтобы слабая кислота могла эффективно взаимодействовать с растворителем.
2. Если основание является очень слабым, растворитель также должен проявлять низкие основные свойства (низкая Kb), чтобы слабое основание могло взаимодействовать с титрантом.
3. Чем ниже константа автопротолиза растворителя (Ks), тем более резким будет скачок потенциала в точке эквивалентности, что улучшает точность измерений.
Использование неводных растворителей значительно расширяет возможности кислотно-основного титрования, позволяя работать с широким диапазоном веществ, включая те, которые не могут быть эффективно проанализированы в воде. Это делает метод полезным для химического анализа сложных систем, где необходимы точные и селективные измерения.
Многие неводные растворители обладают так называемыми дифференцирующими свойствами, которые позволяют селективно определять вещества с близкими значениями pK в водных растворах.
Неводные среды имеют несколько особенностей, которые необходимо учитывать:
– Коэффициент расширения органических растворителей значительно выше, чем у воды. В результате зависимость титра от температуры может быть очень значительной — до 0,2% при изменении температуры на 1°C.
– Многие неводные растворители более летучи, чем вода, и чувствительны к воздействию CO₂. Поэтому необходимо часто проверять титр для обеспечения точности.
Примеры титрантов, используемых в неводных растворителях:
– Кислоты: HCl в изопропаноле, хлорная кислота в ледяной уксусной кислоте.
– Основания: KOH в этаноле, метоксид натрия в хлорбензоле.
У нас вы найдете широкий ассортимент автоматических титраторов. Мы предлагаем различные модели приборов, которые удовлетворят потребности как малых лабораторий, так и крупных производств. Наша команда профессионалов готова помочь вам настроить любые методы титрования, обеспечивая точность и надежность результатов. Если вы хотите узнать больше о моделях титраторов и их возможностях, свяжитесь с нами, и мы с радостью предоставим всю необходимую информацию! Узнать подробнее про модели титраторов.

Окислительно-восстановительное титрование
Окислительно-восстановительное титрование (редокс-титрование) основано на реакциях, где происходит изменение степени окисления реагентов. Этот метод часто используется для анализа содержания окислителей и восстановителей. В зависимости от свойств определяемого вещества и используемых титрованных растворов различают методы окислительного титрования и методы восстановительного титрования.
Для фиксирования точки эквивалентности при окислительно-восстановительном титровании используют окислительно-восстановительные индикаторы (редокс-индикаторы), которые при достижении определенного потенциала, зависящего от присутствия в растворе окислителей или восстановителей, изменяют цвет. Вместо индикаторного титрования можно использовать автоматический титратор с редокс-датчиком.
Вещества, которые могут окислять другие вещества, называются окислителями, а вещества, способные восстанавливать другие вещества, — восстановителями. Однако, поскольку электроны не существуют в свободном состоянии в заметной концентрации, окисление и восстановление всегда происходят одновременно. Одна реакция высвобождает ровно столько электронов, сколько требуется для другой реакции. Таким образом, в любой окислительно-восстановительной реакции участвуют две сопряженные пары:
Red₁ + Ox₂ → Ox₁ + Red₂
Примеры реакций:
Fe + Cu²⁺ → Fe²⁺ + Cu
2I⁻ + Br₂ → I₂ + 2Br⁻
Сравнивая несколько таких реакций, можно качественно определить силу окислителей или восстановителей. Как и в случае с кислотами и основаниями, восстановители и окислители можно расположить в ряд, называемый рядом активности.
Восстановители и соответствующие им окислители расположены в порядке увеличения силы:
Fe / Fe²⁺
S₂O₃²⁻ / S₄O₆²⁻
Cu / Cu²⁺
2I⁻ / I₂
Ag / Ag⁺
2Br⁻ / Br₂
2Cl⁻ / Cl₂
Cr³⁺ / Cr₂O₇²⁻
Au / Au³⁺
Mn²⁺ / MnO₄⁻
Ce³⁺ / Ce⁴⁺
F⁻ / F₂
Правила использования:
Чем выше в списке восстановитель, тем он сильнее (легче отдает электроны)
Чем ниже в списке окислитель, тем он сильнее (легче принимает электроны)
Реакция возможна, если восстановитель находится выше окислителя в ряду
Этот ряд активности показывает представительный набор окислительно-восстановительных пар, включая не только самые известные титранты, но и несколько металлов и галогенов.
Перманганатометрия.
Перманганатометрия – метод окислительно-восстановительного титрования, в котором основным титрованным раствором является раствор калия перманганата. Фиксирование конечной точки титрования в бесцветных растворах может происходить без индикатора – по окрашиванию раствора в розовый цвет, в окрашенных растворах – с применением индикатора, например, ферроина. Прямое перманганатометрическое титрование восстановителей проводят в сильнокислой среде, которую создают прибавляя избыток серной кислоты. В перманганатометрии можно применять способы обратного и заместительного титрования.
Пример реакции:
Титрование раствора перманганата калия (KMnO₄) с раствором оксалата натрия (Na₂C₂O₄) в кислой среде:
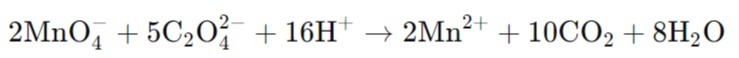
Йодометрия.
Йодометрия – метод окислительно-восстановительного титрования, в котором основными титрованными растворами являются растворы йода и растворы тиосульфата натрия. Фиксирование конечной точки титрования осуществляют с применением специфического индикатора − крахмала, который образует с йодом соединение, окрашенное в синий цвет. При проведении йодометрического титрования из-за летучести йода требуется выполнение некоторых специальных условий: титрование проводить при комнатной температуре, реакционную смесь при йодометрическом титровании необходимо выдерживать в темноте, закрывать реакционные колбы пробками. Йодометрическое титрование проводят в нейтральной или слабокислой среде. К титрованию выделившегося в ходе реакции йода приступают не сразу, а минут через 5 после начала реакции образования йода при прибавлении соответствующего реактива. Прямое титрование стандартным раствором йода используют, например, для определения сильных восстановителей, прибавляя индикатор крахмал до начала титрования и титруют до появления окраски. При обратном йодометрическом титровании, используемым для веществ, которые труднее окисляются или подвергаются другим процессам под воздействием йода, избыток раствора йода после реакции с определяемым веществом титруют стандартным раствором натрия тиосульфата.
Броматометрия.
Броматометрия – метод окислительно-восстановительного титрования, при котором в качестве основного титрованного раствора используют раствор калия бромата, являющийся является сильным окислителем в кислой среде. Фиксирование конечной точки титрования осуществляют с помощью индикаторов, в кислой среде окрашивающих титруемый раствор в красный цвет, исчезновение окраски титруемого раствора свидетельствует об окончании титрования.
При прямой броматометрии титрованным раствором калия бромата в кислой среде титруют испытуемый раствор, содержащий определяемое вещество с восстановительными свойствами. Титрование ведут медленно во избежание локального образования брома в растворе до достижения точки эквивалентности.
Комплексонометрическое титрование
Комплексонометрическое титрование используется для определения концентрации ионов металлов в растворе. Основой метода является образование стабильных комплексных соединений между металлами и лигандами, такими как ЭДТА (этилендиаминтетрауксусная кислота).
Пример реакции:
Титрование раствора ионов кальция (Ca²⁺) раствором ЭДТА:
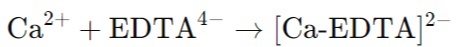
Осадительное титрование
Осадительное титрование основано на реакции образования осадка. Этот метод применяется для определения ионов, которые образуют малорастворимые соединения.
Аргентометрия
Аргентометрия − метод осадительного титрования (титрования по методу осаждения), в котором основным стандартным раствором является титрованный раствор серебра нитрата. Метод используют для определения галогенидов, тиоцианатов, цианидов, фосфатов и других ионов. Точку эквивалентности определяют с помощью индикаторов, например хромата калия или титрованием потенциометрическим титратором с электродом для осадительного титрования.
Пример реакции:
Титрование раствора хлорида натрия (NaCl) раствором нитрата серебра (AgNO₃):
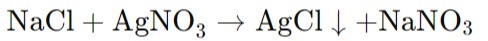
Меркуриметрия.
Меркуриметрия − титриметрический метод анализа, в частности осадительное титрование, в котором основным стандартным раствором является титрованный раствор ртути(II) нитрата. Метод основан на образовании устойчивых слабодиссоциированных (малорастворимых) комплексных соединений ртути(II) при взаимодействии титрованного раствора ртути(II) нитрата c галогенидами, тиоцианатами, цианидами в кислой среде, достигаемой прибавлением азотной кислоты. Меркуриметрию рассматривают как метод осадительного титрования, но так как в результате реакции образуются комплексные соединения, то и как разновидность комплексонометрического титрования. Фиксирование точки эквивалентности проводят индикаторным и безиндикаторным методом.
Для проведения осадительного и редокс титрования можно порекомендовать российский титратор "Титровойс Автоматик". Титратор позволяет автоматизировать процесс титрования, что значительно упрощает проведение анализов и повышает их точность.

Реакции осаждения коллоидов
Реакции осаждения коллоидов применяются для титрования веществ, образующих коллоидные осадки. Этот метод используется для определения концентрации таких веществ в растворе.
Пример реакции:
Титрование раствора, содержащего анионные ПАВ в моющих средствах, стиральных порошках.
Каждый тип титрования имеет свои специфические области применения и базируется на различных химических реакциях. Кислотно-основное титрование используется для нейтрализации, окислительно-восстановительное титрование — для редокс-реакций, комплексонометрическое титрование — для образования комплексных соединений, осадительное титрование — для реакций осаждения, а реакции осаждения коллоидов — для коагуляции коллоидных частиц. Понимание этих процессов позволяет выбрать наиболее подходящий метод для анализа конкретных веществ и получить точные результаты.
Сервис автоматических титраторов
Мы оказываем полную поддержку на всех этапах установки и запуска в эксплуатацию, а также предлагаем дальнейшее сервисное обслуживание. Проводим настройку методик, диагностику, ремонт, квалификацию, обучение. Узнать подробнее

Проведем у Вас тренинг: Экспертное Титрование
Профессиональный тренинг для пользователей, желающих улучшить свои навыки в работе с автоматическими титраторами. Узнать подробнее
 POWER Full 14POWER Full 141000₽
POWER Full 14POWER Full 141000₽ POWER Full 14POWER Full 142000₽
POWER Full 14POWER Full 142000₽
Оставляя заявку, вы соглашаетесь на обработку персональных данных.