
Определение железа титриметрическими методами
Железо — один из ключевых элементов в промышленности, экологическом мониторинге и научных исследованиях. Его количественное определение необходимо для контроля качества металлургической продукции, анализа природных вод, оценки почв и биологических материалов. Среди множества методов анализа титриметрия остаётся востребованной благодаря простоте, высокой точности и доступности реагентов.
Титриметрические методы определения железа основаны на реакциях окисления-восстановления (перманганатометрия, дихроматометрия) и комплексообразования (комплексонометрия). Каждый из них имеет свои преимущества:
Комплексонометрия с трилоном Б (ЭДТА) позволяет точно определять Fe³⁺ даже в присутствии мешающих ионов.
Окислительно-восстановительные методы идеальны для анализа Fe²⁺ в кислых средах.
Иодометрия применяется для косвенного анализа Fe³⁺ в рудах и технологических растворах.
В этой статье мы подробно разберём все основные титриметрические методики, их химические основы, расчётные формулы и практические нюансы. Отдельное внимание уделим подготовке проб, выбору индикаторов и интерпретации результатов.
Титриметрические методы определения железа (Fe) широко используются благодаря их точности и простоте. Основные методы включают:
Комплексонометрическое определение железа(III) с трилоном Б
Принцип метода
В основе методики лежит способность ионов железа(III) образовывать устойчивый водорастворимый комплекс с трилоном Б (динатриевой солью ЭДТА). Реакция протекает в сильнокислой среде при pH ≈ 2, что обеспечивает селективность определения и предотвращает гидролиз железа.
Особенности методики
Условия проведения анализа:
Оптимальная кислотность (pH 1.5-2.0) создается добавлением серной кислоты
Нагрев раствора до 60-70°C ускоряет комплексообразование
В качестве индикатора используется сульфосалициловая кислота
Ход анализа:
В подготовленной пробе появляется вишневая окраска при добавлении индикатора
В процессе титрования цвет изменяется на лимонно-желтый в точке эквивалентности
Переход окраски четкий и хорошо различимый визуально
Аналитические характеристики:
Диапазон определяемых концентраций: 0.1-20 г/дм³
Погрешность метода: ±2-3% отн.

Мешающие влияния и их устранение при титровании железа(III) трилоном Б
Медь (Cu²⁺)
Образует устойчивый комплекс с трилоном Б даже при pH 2, конкурируя с Fe³⁺. Искажает результаты при концентрациях выше 0.1 мг/л. Для устранения мешающего влияния меди используют добавление тиомочевины – она маскирует медь, образуя бесцветный комплекс. При высоких концентрациях меди (более 10 мг/л) может потребоваться экстракция диэтилдитиокарбаматом.
Алюминий (Al³⁺)
Связывается с трилоном Б в слабокислой среде, мешая определению железа. Вызывает нечеткое изменение цвета индикатора. Для устранения влияния алюминия применяют триэтаноламин или фторид натрия (NaF), который связывает Al³⁺ в устойчивый комплекс. Избыток фторида нейтрализуют борной кислотой, чтобы избежать маскирования железа.
Обратное титрование как альтернативный метод
Когда прямое маскирование алюминия невозможно, применяют метод обратного титрования с использованием двух индикаторов. В этом случае сначала вносят избыток трилона Б, который связывает все металлы в пробе — как железо (Fe³⁺), так и алюминий (Al³⁺). Затем непрореагировавший избыток трилона оттитровывают стандартным раствором цинка (Zn²⁺) с индикатором эриохромом чёрным Т, что позволяет определить общее содержание металлов. Для выделения именно железа берут новую порцию пробы, где Fe³⁺ специально маскируют (например, восстанавливают аскорбиновой кислотой до Fe²⁺), после чего титруют оставшийся алюминий. Разница между общим расходом трилона и объёмом, пошедшим на алюминий, соответствует количеству железа в пробе. Этот подход особенно полезен при анализе сложных многокомпонентных смесей, где прямое определение железа затруднено.
Органические соединения
Маскируют ионы железа, образуя с ним комплексы. Для устранения этого эффекта проводят минерализацию пробы смесью серной и азотной кислот или используют окисление перекисью водорода в щелочной среде.
Взвешенные вещества
Могут адсорбировать индикатор или мешать визуальному определению точки эквивалентности. Для устранения этого влияния пробу фильтруют через мембранный фильтр или центрифугируют.
Ионы, которые не мешают при pH < 2
Кальций (Ca²⁺), магний (Mg²⁺) и щелочные металлы (Na⁺, K⁺) не мешают определению железа в сильнокислой среде. Цинк (Zn²⁺), никель (Ni²⁺) и кобальт (Co²⁺) начинают влиять только при pH выше 3.
Дополнительные рекомендации
Если мешающих ионов слишком много, можно использовать методы предварительного разделения, например экстракцию или ионообменную хроматографию. Для сложных проб рекомендуется применять метод стандартных добавок или строить градуировочный график. В сильнокислой среде большинство двухзарядных катионов не мешают анализу, что упрощает определение железа в присутствии Ca²⁺ и Mg²⁺.
Расчет результатов
Содержание железа рассчитывают по формуле:
c=V×c×39.92/m
где:
V - объем раствора трилона Б, мл
c - нормальность раствора трилона Б
m - объем анализируемой пробы, мл
39.92 - грамм-эквивалент Fe₂O₃ для данной реакции
Метод обеспечивает достаточную точность для технологического контроля и может быть адаптирован для анализа различных объектов.
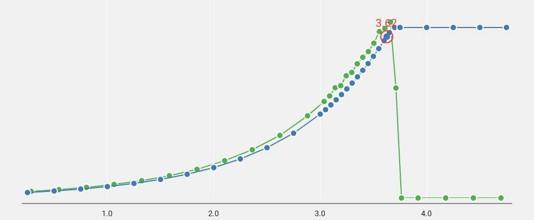
На рисунке приведена кривая титрования железа 3 трилоном Б в присутствии сульфосалициловой кислоты, полученная на автоматическом титраторе Титровойс Автоматик с фотометрическим датчиком.
Окислительно-восстановительные методы определения железа
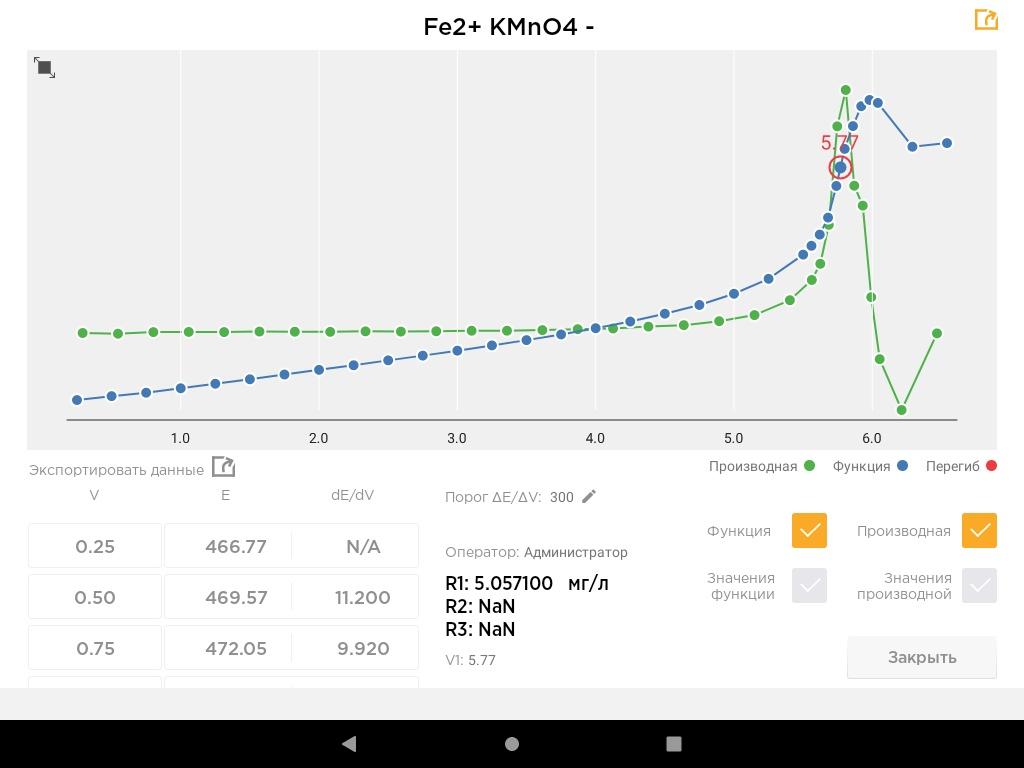
Перманганатометрическое определение железа(II)
Принцип метода
Метод основан на окислении ионов железа(II) перманганатом калия в сильнокислой среде. Реакция протекает количественно по уравнению:
5Fe²⁺ + MnO₄⁻ + 8H⁺ → 5Fe³⁺ + Mn²⁺ + 4H₂O
Особенности методики
Условия проведения анализа:
Оптимальная кислотность (pH 0.5-1.5) создаётся добавлением серной кислоты (H₂SO₄)
Концентрация кислоты: 1-2 М в конечном растворе
Ход анализа:
В подготовленной пробе появляется розовая окраска при добавлении перманганата
В процессе титрования окраска исчезает по мере расходования KMnO₄
В точке эквивалентности появляется устойчивое слабо-розовое окрашивание от 1 капли избытка титранта
Аналитические характеристики:
Диапазон определяемых концентраций: 0.01-5 г/дм³
Мешающие влияния и их устранение
Хлорид-ионы (Cl⁻):
Окисляются перманганатом при концентрациях >100 мг/л, что приводит к завышенным результатам. Для устранения:
Используют специальный реактив Циммерманна-Рейнхардта (содержащий MnSO₄ и H₃PO₄)
Органические вещества:
Могут окисляться перманганатом. Устраняют:
Предварительной обработкой проб смесью H₂SO₄ + KMnO₄
Другие восстановители (NO₂⁻, S²⁻, SO₃²⁻):
Мешают определению. Устраняют:
Предварительным окислением перекисью водорода
Пропусканием пробы через ионообменную колонку
Автоматизированное титрование
При использовании титратора с редокс-датчиком:
Платиновый электрод регистрирует скачок потенциала
Кривая титрования имеет четкий перегиб в точке эквивалентности
Преимущества автоматизации:
Возможность анализа мутных и окрашенных растворов
Исключение субъективной ошибки при определении конечной точки
Автоматический расчёт результатов
Расчёт результатов
Содержание железа(II) рассчитывают по формуле:
c(Fe²⁺) = V × c × 55.85 / m
где:
V - объём KMnO₄, пошедший на титрование, мл
c - молярная концентрация 1/5 KMnO₄, моль/л
m - объём анализируемой пробы
55.85 - молярная масса железа, г/моль
Дихроматометрическое определение железа(II)
Принцип метода
Метод основан на окислении ионов железа(II) дихроматом калия в кислой среде. Реакция протекает количественно по уравнению:
6Fe2++Cr2O72−+14H+→6Fe3++2Cr3++7H2O6Fe2++Cr2O72−+14H+→6Fe3++2Cr3++7H2O
В качестве индикатора часто используют дифениламин или ферроин, резко меняющий окраску в точке эквивалентности. При использовании титратора с платиновым редокс-электродом находят скачек потенциала в точке эквивалентности.
Особенности методики
Условия проведения анализа:
Кислотность среды (pH <1) обеспечивается серной.
Концентрация кислоты: 1-2 М в конечном растворе.
Ход анализа:
При титровании K₂Cr₂O₇ раствор постепенно меняет окраску (например, от красно-оранжевого до зелёного в случае ферроина).
В точке эквивалентности наблюдается резкое изменение цвета и потенциала раствора соответствующее полному окислению Fe²⁺.
Аналитические характеристики
Диапазон определяемых концентраций: 0.01–10 г/дм³.
Точность и воспроизводимость: высокая, погрешность ≤1%.
Мешающие влияния и их устранение
Хлорид-ионы (Cl⁻)
В высоких концентрациях (>100 мг/л) могут окисляться дихроматом.
Органические вещества
Могут восстанавливать K₂Cr₂O₇.
Устранение:
Прокаливание пробы.
Обработка персульфатом калия (K₂S₂O₈).
Другие восстановители (NO₂⁻, S²⁻, SO₃²⁻)
Мешают определению, окисляясь дихроматом.
Устранение:
Предварительное окисление пероксидом водорода (H₂O₂).
Пропускание через ионообменную колонку.
Преимущества дихроматометрии перед перманганатометрией в определении железа(II)
Дихроматометрическое титрование железа(II) обладает существенными преимуществами по сравнению с перманганатометрическим методом, что делает его более предпочтительным во многих аналитических исследованиях.
Стабильность титранта является одним из ключевых преимуществ. Дихромат калия (K₂Cr₂O₇) служит первичным стандартом, что позволяет точно приготовить раствор по навеске без необходимости дополнительной стандартизации. В отличие от него, перманганат калия (KMnO₄) требует регулярной перестандартизации, так как подвержен разложению под действием света и в присутствии органических примесей.
Меньшая чувствительность к примесям - еще одно важное достоинство. Дихромат не окисляет соляную кислоту при отсутствии нагрева, тогда как перманганат активно реагирует с хлоридами, что вынуждает применять специальные меры, такие как использование реактива Циммерманна. Кроме того, дихроматометрия менее чувствительна к органическим веществам, которые могут восстанавливать перманганат, но практически не влияют на дихромат в стандартных условиях анализа.
Более широкий диапазон кислотности также выгодно отличает дихроматометрию. Метод успешно работает при pH менее 1 с использованием серной или соляной кислоты, в то время как перманганатометрия требует строгого контроля кислотности в диапазоне pH 0.5-1.5. В слабокислых средах перманганат может восстанавливаться до диоксида марганца (MnO₂), что приводит к искажению результатов анализа.
Четкость и устойчивость конечной точки титрования - существенное преимущество дихроматометрии. Использование таких индикаторов, как ферроин или дифениламин, обеспечивает резкий и хорошо заметный цветовой переход. Хотя перманганатометрия является самоиндицирующимся методом, слабо-розовая окраска избытка титранта может быть плохо различима в окрашенных или мутных растворах. При автоматическом титровании редокс-скачок потенциала для системы Cr₂O₇²⁻/Cr³⁺ выражен более четко, чем для MnO₄⁻/Mn²⁺.
Устойчивость к мешающим ионам - еще один плюс дихроматометрии. Дихромат не взаимодействует с нитратами и сульфатами, тогда как перманганат способен окислять нитраты в сильнокислой среде. Метод также менее чувствителен к присутствию некоторых восстановителей, таких как небольшие количества олова(II) или титана(III).
Несмотря на перечисленные преимущества, перманганатометрия остается предпочтительной в некоторых случаях, например, при необходимости последовательного анализа железа(II) и железа(III) после предварительного восстановления.
В целом, дихроматометрия превосходит перманганатометрию по точности, стабильности и удобству выполнения, особенно при использовании автоматических титраторов. Однако окончательный выбор метода всегда должен учитывать специфику анализируемой пробы и условия проведения анализа.
Цериметрическое определение железа(II)
Цериметрия представляет собой высокоэффективный метод определения двухвалентного железа, особенно удобный для автоматизированного анализа. В основе метода лежит реакция окисления ионов Fe²⁺ до Fe³⁺ с использованием церия(IV) в качестве титранта. Данный подход широко применяется в современных лабораториях благодаря своей точности и хорошей совместимости с автоматическими титрационными системами.
Принцип метода и особенности
При церемитрическом титровании происходит стехиометрическая реакция между ионами церия(IV) и двухвалентным железом в кислой среде. Процесс описывается уравнением: Ce⁴⁺ + Fe²⁺ → Ce³⁺ + Fe³⁺. В качестве титранта обычно используют растворы сульфата церия(IV) или аммонийного церия(IV) сульфата, которые отличаются высокой стабильностью и не требуют частой перестандартизации, что особенно важно при работе на автоматических системах.
Оптимальные условия анализа предполагают использование сернокислой среды с концентрацией 0.5-1 M. Важным преимуществом метода является его устойчивость к небольшим количествам хлорид-ионов, что выгодно отличает его от перманганатометрии.
Преимущества автоматизированного церемитрического анализа
Автоматические титраторы значительно расширяют возможности церемитрического метода. Платиновый редокс-электрод четко фиксирует момент эквивалентности, обеспечивая высокую точность измерений. Кривые титрования имеют ярко выраженный перегиб, что позволяет алгоритмам титратора точно определять конечную точку без субъективных ошибок, характерных для визуальной индикации.
Метод демонстрирует отличную воспроизводимость результатов при работе на автоматических системах. Стандартный потенциал системы Ce⁴⁺/Ce³⁺ (+1.44 В) идеально подходит для определения железа(II), обеспечивая количественное протекание реакции. В отличие от перманганатометрии, церемитрическое титрование не требует строгого контроля кислотности и менее чувствительно к присутствию органических примесей.
Особенности работы с автоматическими системами
При использовании титраторов важное значение приобретает правильная подготовка электродной системы. Платиновый электрод нуждается в периодической активации для поддержания чувствительности. Современные титраторы позволяют автоматизировать процесс калибровки электрода и стандартизации титранта, что существенно повышает производительность лаборатории.
Автоматизация процесса дает возможность анализировать мутные и окрашенные растворы, которые представляют сложность для методов с визуальной индикацией. Встроенные алгоритмы расчета позволяют сразу получать результаты в требуемых единицах измерения, минимизируя ручные вычисления.

Иодометрическое определение железа(III) на автоматических титраторах
Иодометрия представляет собой надежный косвенный метод определения трехвалентного железа, особенно эффективный при автоматизированном выполнении. Метод основан на восстановлении Fe³⁺ иодид-ионами с последующим титрованием выделившегося йода.
Принцип метода и химические основы
Процесс анализа включает две последовательные реакции:
Восстановительная стадия: 2Fe³⁺ + 2I⁻ → 2Fe²⁺ + I₂
Титрование: I₂ + 2S₂O₃²⁻ → 2I⁻ + S₄O₆²⁻
Особенностью метода является необходимость строгого контроля кислотности. Оптимальные результаты достигаются в слабокислой среде (pH 3-5), что предотвращает побочные реакции иода с тиосульфатом.
Для достижения наилучших результатов рекомендуется:
Использовать свежеприготовленный раствор KI высокой чистоты
Поддерживать строгий контроль pH анализируемого раствора
Применять защиту от света во избежание фотохимического разложения иода
Использовать термостатирование при работе с температурно-чувствительными пробами
Титрование с хлоридом олова(II) для определения железа(III)
Метод основан на восстановлении Fe³⁺ до Fe²⁺ с помощью хлорида олова(II) с последующим титрованием полученного Fe²⁺ стандартными методами (перманганатометрия, дихроматометрия или цериметрия). Этот подход особенно эффективен при автоматизированном выполнении, обеспечивая высокую точность и воспроизводимость результатов.
Принцип метода и химические основы
Процесс анализа включает две ключевые стадии:
Восстановительная стадия: 2Fe³⁺ + Sn²⁺ → 2Fe²⁺ + Sn⁴⁺
Титрование полученного Fe²⁺ выбранным окислителем (например, K₂Cr₂O₇)
Особенностью метода является необходимость точного контроля избытка восстановителя. Для этого используют:
Индикаторные методы (ртуть(II) хлорид для фиксации избытка Sn²⁺)
Потенциометрический контроль в автоматических системах
Метод отличается высокой селективностью и может быть адаптирован для широкого диапазона концентраций (от следовых количеств до высоких содержаний).Для сложных матриц возможно сочетание с другими методами (например, предварительное отделение мешающих элементов), что также может быть реализовано в автоматизированных системах.
Комплексонометрическое определение смеси Fe²⁺ и Fe³⁺
Для анализа проб, содержащих оба валентных состояния железа, применяют комплексонометрический метод с использованием трилона Б (ЭДТА). Методика основана на последовательном определении трехвалентного железа и общего содержания железа после предварительного окисления двухвалентной формы.
Принцип анализа
Определение проводят в два этапа. Сначала измеряют содержание Fe³⁺ путем прямого титрования трилоном Б в кислой среде. Затем пробу обрабатывают пероксидом водорода для полного окисления Fe²⁺ до Fe³⁺ и повторяют титрование для определения общего содержания железа. Кислотность среды регулируют добавлением серной кислоты до достижения оптимального диапазона pH 1.5-2.0.
Процедура анализа
Перед началом измерений пробу подкисляют серной кислотой до необходимого уровня кислотности. Для определения Fe³⁺ раствор сразу титруют трилоном Б в присутствии сульфосалициловой кислоты в качестве индикатора. О завершении реакции свидетельствует изменение окраски от фиолетовой до желтой.
Для определения общего железа в отдельную аликвоту пробы добавляют пероксид водорода и нагревают для полного окисления Fe²⁺. После охлаждения раствор снова титруют трилоном Б по той же методике. Разность между результатами двух титрований соответствует содержанию Fe²⁺ в исходной пробе.
Критические параметры метода
Температурный режим играет важную роль в анализе. Концентрация серной кислоты должна быть достаточной для поддержания стабильного pH, но не чрезмерной, чтобы не препятствовать работе индикатора.
Количество добавляемого пероксида водорода должно быть строго контролируемым. После добавления окислителя необходимо выдержать пробу при нагревании в течение 2-3 минут для завершения процесса окисления.
Заключение
Титриметрические методы определения железа остаются важным инструментом в аналитической химии благодаря своей точности, доступности и широкой применимости. Рассмотренные методики – комплексонометрия, перманганатометрия, дихроматометрия, цериметрия и иодометрия – позволяют надежно определять железо в различных формах (Fe²⁺ и Fe³⁺) и матрицах, от природных вод до металлических сплавов и руд.
Ключевыми преимуществами этих методов являются:
Высокая точность и воспроизводимость результатов
Относительная простота выполнения
Возможность автоматизации процесса
Широкий диапазон определяемых концентраций
Хорошая селективность при правильном выборе условий анализа
Современные автоматические титраторы значительно расширяют возможности титриметрических методов, устраняя субъективные ошибки и повышая производительность. Особенно это важно при серийных анализах и работе с окрашенными или мутными растворами.
Выбор конкретного метода должен основываться на:
Форме железа в пробе (Fe²⁺, Fe³⁺ или их смесь)
Матрице анализируемого образца
Наличии мешающих компонентов
Требуемой точности и производительности
При правильном применении и учете всех факторов титриметрические методы обеспечивают надежные результаты, что делает их незаменимыми для технологического контроля, экологического мониторинга и научных исследований. Дальнейшее развитие этих методик связано с совершенствованием автоматизированных систем и разработкой новых индикаторов для более точного определения конечной точки титрования.
Мы предлагаем широкий ассортимент потенциометрических титраторов для решения любых аналитических задач – от рутинных измерений до сложных научных исследований. В нашем портфолие представлены модели различной комплектации: компактные решения для малых лабораторий, высокопроизводительные системы для серийных анализов и специализированные установки для работы с агрессивными средами. Наши эксперты помогут подобрать оптимальную конфигурацию оборудования, включая необходимые датчики, бюретки и дополнительное оснащение, а также проконсультируют по методикам проведения анализов в соответствии с вашими задачами и отраслевыми стандартами. Свяжитесь с нами – и мы вместе найдем лучшее решение для вашей лаборатории!
Модели автоматических титраторов в продаже

Качество результатов начинается с правильной настройки
Точность и достоверность результатов титрования напрямую зависят от корректной настройки оборудования и квалификации оператора. Даже самый современный титратор может выдавать недостоверные результаты, если методика не правильно адаптирована под конкретные образцы, а персонал не обучен работе с прибором. Неправильно выбранные параметры (скорость дозирования, определения точки эквивалентности, условия перемешивания, учет холостой) способны исказить данные и привести к ошибочным выводам. Именно поэтому профессиональная настройка и обучение – не просто дополнительная услуга, а обязательный этап внедрения титратора в лабораторную практику.
Комплексное сопровождение – гарантия точности и надежности
Наша компания предлагает полный цикл поддержки – от первичной установки оборудования до регулярного сервисного обслуживания. Мы не просто поставляем титраторы, а обеспечиваем их оптимальную работу под ваши задачи:
Настройка методик – адаптация параметров под конкретные образцы и стандарты (ГОСТ, ASTM, Фармакопея, внутренние регламенты);
Обучение персонала – от базовых принципов работы до сложных методов анализа;
Техническое сопровождение – диагностика, ремонт, квалификация оборудования;
Сервисная поддержка – регулярные проверки, обновление ПО, консультации.
Наши специалисты помогут вам максимально реализовать потенциал оборудования, минимизировать риски ошибок и обеспечить соответствие результатов требованиям нормативной документации. Доверяя нам, вы получаете не просто прибор, а готовое решение под ключ с гарантией точности и долговечности. Узнать подробнее

 POWER Full 14POWER Full 141000₽
POWER Full 14POWER Full 141000₽ POWER Full 14POWER Full 142000₽
POWER Full 14POWER Full 142000₽
Оставляя заявку, вы соглашаетесь на обработку персональных данных.